题目内容
某课外活动小组为了检测本地钢铁厂生铁产品的质量,进行实验.测得相关数据如图所示:
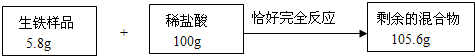
(1)该生铁样品中铁的质量分数?
(2)所用稀盐酸的溶质质量分数?

(1)该生铁样品中铁的质量分数?
(2)所用稀盐酸的溶质质量分数?
分析:依据反应前后的质量变化可求出生成的氢气质量,利用氢气的质量结合方程式可以求出铁的质量,进而可求相关的问题答案;
解答:解:反应后生成H2 的质量为5.8g+100g-105.6g=0.2g
设生铁样品中铁的质量为x,稀盐酸中溶质的质量为y
Fe+2HCl═FeCl2+H2↑
56 73 2
x y 0.2g
=
=
x=5.6g y=7.3g
(1)该生铁样品中铁的质量分数为
×100%=96.6%
(2)所用稀盐酸的溶质质量分数为
×100%=7.3%
答:(1)该生铁样品中铁的质量分数为96.6%;(2)所用稀盐酸的溶质质量分数为7.3%;
设生铁样品中铁的质量为x,稀盐酸中溶质的质量为y
Fe+2HCl═FeCl2+H2↑
56 73 2
x y 0.2g
| 56 |
| 2 |
| x |
| 0.2g |
| 73 |
| 2 |
| y |
| 0.2g |
x=5.6g y=7.3g
(1)该生铁样品中铁的质量分数为
| 5.6g |
| 5.8g |
(2)所用稀盐酸的溶质质量分数为
| 7.3g |
| 100g |
答:(1)该生铁样品中铁的质量分数为96.6%;(2)所用稀盐酸的溶质质量分数为7.3%;
点评:本考点考查了根据化学方程式的计算,属于质量分数和化学方程式的综合应用,解题的关键是利用质量守恒定律求出氢气的质量.

练习册系列答案
相关题目