题目内容
工业绿矾(主要成分FeSO4?7H2O),其中所含固体杂质不含铁元素、不溶于水、加热也不分解.用铁的质量分数为18%以上的工业绿矾可生产复印用高档Fe3O4粉.
(一)原料工业绿矾中铁的质量分数测定
称取30g硫酸亚铁晶体样品按图1高温加热,使其完全分解,相关数据如图2,对所得产物进行探究,并测定样品中铁的质量分数.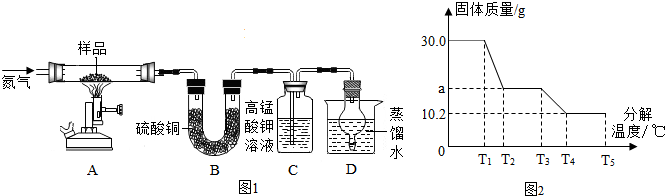
【查阅资料1】绿矾晶体在T1时开始分解,T2时完全失去水,T3时FeSO4开始分解.
(1)实验前,应先 .
(2)装置B中硫酸铜粉末变蓝,说明产物中有 ,装置C中高锰酸钾溶液褪色,说明产物中还有 .
(3)装置A中固体变成红棕色,放入稀盐酸,得黄色溶液,则该红棕色固体是 .
(4)装置D球形干燥管的作用 .
(5)从理论上分析,硫酸亚铁晶体分解还生成SO3.根据相关数据分析:①图2中T3至T4过程的反应化学方程式 ;②样品中铁的质量分数= .
(6)实验中要持续通入氮气,否则测出的铁的质量分数会 (填“偏大”、“偏小”或“不变”).
(二)生产复印用高档Fe3O4粉
【生产流程】
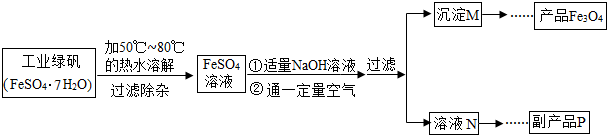
【查阅资料2】
①硫酸亚铁在不同温度下的溶解度如表所示:
②Fe(OH)2易氧化:4Fe(OH)2+2H2O+O2=4Fe(OH)3
③获得Fe3O4的反应原理为:Fe(OH)2+2Fe(OH)3
Fe3O4+4H2O
(1)溶解时,用50℃至80℃的热水目的是 .
(2)写出加入适量NaOH溶液时发生反应的化学方程式 .
(3)副产品P的化学式是 .
(4)沉淀M需洗净,检验是否洗净的方法是 .
(5)若流程中产生的Fe(OH)2和Fe(OH)3的质量比为50:107,则所得产品是 的Fe3O4(填“纯净”或“不纯净”).
(一)原料工业绿矾中铁的质量分数测定
称取30g硫酸亚铁晶体样品按图1高温加热,使其完全分解,相关数据如图2,对所得产物进行探究,并测定样品中铁的质量分数.

【查阅资料1】绿矾晶体在T1时开始分解,T2时完全失去水,T3时FeSO4开始分解.
(1)实验前,应先
(2)装置B中硫酸铜粉末变蓝,说明产物中有
(3)装置A中固体变成红棕色,放入稀盐酸,得黄色溶液,则该红棕色固体是
(4)装置D球形干燥管的作用
(5)从理论上分析,硫酸亚铁晶体分解还生成SO3.根据相关数据分析:①图2中T3至T4过程的反应化学方程式
(6)实验中要持续通入氮气,否则测出的铁的质量分数会
(二)生产复印用高档Fe3O4粉
【生产流程】

【查阅资料2】
①硫酸亚铁在不同温度下的溶解度如表所示:
| 温度/℃ | 0 | 10 | 30 | 50 | 60 | 70 | 80 | 90 |
| 溶解度/g | 14.0 | 17.0 | 25.0 | 33.0 | 35.3 | 33.0 | 30.5 | 27.0 |
③获得Fe3O4的反应原理为:Fe(OH)2+2Fe(OH)3
| ||
(1)溶解时,用50℃至80℃的热水目的是
(2)写出加入适量NaOH溶液时发生反应的化学方程式
(3)副产品P的化学式是
(4)沉淀M需洗净,检验是否洗净的方法是
(5)若流程中产生的Fe(OH)2和Fe(OH)3的质量比为50:107,则所得产品是
考点:实验探究物质的组成成分以及含量,常见气体的检验与除杂方法,盐的化学性质,书写化学方程式、文字表达式、电离方程式
专题:科学探究
分析:【查阅资料1】
(1)凡是有气体参加或产生的实验,实验前一定要检查装置的气密性,以防装置漏气影响实验结果;
(2)白色硫酸铜粉末遇水变蓝色;二氧化硫具有还原性,能使高锰酸钾溶液褪色;
(3)氧化铁是红棕色固体,能和稀盐酸反应生成氯化铁和水,氯化铁溶液是黄色的;
(4)球形干燥管能够防止液体倒吸;
(5)硫酸亚铁在高温条件下分解能生成氧化铁、二氧化硫和三氧化硫;
根据反应前后的质量差可以计算氧化铁的质量,根据氧化铁的质量可以计算铁元素的质量,进一步可以计算样品中铁的质量分数;
(6)实验中持续通入氮气的目的是为了排出反应生成的水蒸气;
【查阅资料2】
(1)根据硫酸亚铁的溶解度与温度的关系,可以判断在什么温度范围内硫酸亚铁的溶解能力较强;
(2)硫酸亚铁和氢氧化钠反应生成氢氧化亚铁沉淀和硫酸钠;
(3)副产品P是硫酸钠;
(4)取洗涤液适量于试管中,滴加氯化钡溶液,如果产生白色沉淀,说明洗涤不干净;如果不产生白色沉淀,说明洗涤干净;
(5)根据Fe(OH)2+2Fe(OH)3
Fe3O4+4H2O中的氢氧化亚铁和氢氧化铁反应的质量比,可以判断Fe(OH)2和Fe(OH)3按照一定的质量比反应时,得到的四氧化三铁是否纯净.
(1)凡是有气体参加或产生的实验,实验前一定要检查装置的气密性,以防装置漏气影响实验结果;
(2)白色硫酸铜粉末遇水变蓝色;二氧化硫具有还原性,能使高锰酸钾溶液褪色;
(3)氧化铁是红棕色固体,能和稀盐酸反应生成氯化铁和水,氯化铁溶液是黄色的;
(4)球形干燥管能够防止液体倒吸;
(5)硫酸亚铁在高温条件下分解能生成氧化铁、二氧化硫和三氧化硫;
根据反应前后的质量差可以计算氧化铁的质量,根据氧化铁的质量可以计算铁元素的质量,进一步可以计算样品中铁的质量分数;
(6)实验中持续通入氮气的目的是为了排出反应生成的水蒸气;
【查阅资料2】
(1)根据硫酸亚铁的溶解度与温度的关系,可以判断在什么温度范围内硫酸亚铁的溶解能力较强;
(2)硫酸亚铁和氢氧化钠反应生成氢氧化亚铁沉淀和硫酸钠;
(3)副产品P是硫酸钠;
(4)取洗涤液适量于试管中,滴加氯化钡溶液,如果产生白色沉淀,说明洗涤不干净;如果不产生白色沉淀,说明洗涤干净;
(5)根据Fe(OH)2+2Fe(OH)3
| ||
解答:解:【查阅资料1】
(1)实验前,应先检查装置的气密性.
故填:检查装置的气密性.
(2)装置B中硫酸铜粉末变蓝,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有二氧化硫.
故填:水;二氧化硫.
(3)装置A中固体变成红棕色,放入稀盐酸,得黄色溶液,则该红棕色固体是氧化铁.
故填:氧化铁.
(4)装置D球形干燥管的作用防止蒸馏水倒吸.
故填:防止蒸馏水倒吸.
(5)①图2中T3至T4过程的反应化学方程式为:2FeSO4
Fe2O3+SO2↑+SO3↑.
故填:2FeSO4
Fe2O3+SO2↑+SO3↑.
②解:设反应生成的氧化铁的质量为x,
2FeSO4?7H2O
14H2O+SO2↑+SO3↑+Fe2O3 △m(包括水、二氧化硫、三氧化硫)
556 160 396
x 30.0g-10.2g
=
,
x=8g,
铁元素的质量为:8g×
×100%=5.6g,
样品中铁元素的质量分数为:
×100%=18.7%;
故填:18.7%.
(6)如果不通入氮气,分解产生的水蒸汽在A管中冷凝,A管质量差变小,通过上述计算过程可以知道铁元素计算的质量变小,铁元素的质量分数会偏小.
故填:偏小.
【查阅资料2】
(1)溶解时,用50℃至80℃的热水目的是在50℃~80℃时,硫酸亚铁的溶解度较大,有利于溶解的更多,提高产率.
故填:在50℃~80℃时,硫酸亚铁的溶解度较大,有利于溶解的更多,提高产率.
(2)氢氧化钠和硫酸亚铁反应的化学方程式为:2NaOH+FeSO4═Fe(OH)2↓+Na2SO4.
故填:2NaOH+FeSO4═Fe(OH)2↓+Na2SO4.
(3)副产品P是硫酸钠,硫酸钠的化学式是Na2SO4.
故填:Na2SO4.
(4)沉淀M需洗净,检验是否洗净的方法是取最后洗涤液,滴加BaCl2溶液,如果产生白色沉淀,说明洗涤不干净;如果不产生白色沉淀,说明洗涤干净.
故填:取最后洗涤液,滴加BaCl2溶液.
(5)Fe(OH)2+2Fe(OH)3
Fe3O4+4H2O中,Fe(OH)2和Fe(OH)3的质量比为90:107,若流程中产生的Fe(OH)2和Fe(OH)3的质量比为50:107,因为90:107不等于50:107,则所得产品是不纯净的四氧化三铁.
故填:不纯净.
(1)实验前,应先检查装置的气密性.
故填:检查装置的气密性.
(2)装置B中硫酸铜粉末变蓝,说明产物中有水,装置C中高锰酸钾溶液褪色,说明产物中还有二氧化硫.
故填:水;二氧化硫.
(3)装置A中固体变成红棕色,放入稀盐酸,得黄色溶液,则该红棕色固体是氧化铁.
故填:氧化铁.
(4)装置D球形干燥管的作用防止蒸馏水倒吸.
故填:防止蒸馏水倒吸.
(5)①图2中T3至T4过程的反应化学方程式为:2FeSO4
| ||
故填:2FeSO4
| ||
②解:设反应生成的氧化铁的质量为x,
2FeSO4?7H2O
| ||
556 160 396
x 30.0g-10.2g
| 160 |
| x |
| 396 |
| 30.0g-10.2g |
x=8g,
铁元素的质量为:8g×
| 112 |
| 160 |
样品中铁元素的质量分数为:
| 5.6g |
| 30.0g |
故填:18.7%.
(6)如果不通入氮气,分解产生的水蒸汽在A管中冷凝,A管质量差变小,通过上述计算过程可以知道铁元素计算的质量变小,铁元素的质量分数会偏小.
故填:偏小.
【查阅资料2】
(1)溶解时,用50℃至80℃的热水目的是在50℃~80℃时,硫酸亚铁的溶解度较大,有利于溶解的更多,提高产率.
故填:在50℃~80℃时,硫酸亚铁的溶解度较大,有利于溶解的更多,提高产率.
(2)氢氧化钠和硫酸亚铁反应的化学方程式为:2NaOH+FeSO4═Fe(OH)2↓+Na2SO4.
故填:2NaOH+FeSO4═Fe(OH)2↓+Na2SO4.
(3)副产品P是硫酸钠,硫酸钠的化学式是Na2SO4.
故填:Na2SO4.
(4)沉淀M需洗净,检验是否洗净的方法是取最后洗涤液,滴加BaCl2溶液,如果产生白色沉淀,说明洗涤不干净;如果不产生白色沉淀,说明洗涤干净.
故填:取最后洗涤液,滴加BaCl2溶液.
(5)Fe(OH)2+2Fe(OH)3
| ||
故填:不纯净.
点评:合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
向饱和澄清的氢氧化钙溶液中加入一定量的CaO,充分反应后恢复到原来温度.下列说法中,正确的是( )
| A、溶液中溶质质量增多,溶液的质量减少 |
| B、溶液中溶质质量增多,溶液的质量增加 |
| C、溶液中水的质量减少,溶质质量分数不变 |
| D、溶液中水的质量减少,溶质质量分数增大 |


