题目内容
【题目】 (7分) 过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用,某化学研究性学习小组设计并完成了如下实验。

【实验目的】测定过碳酸钠样品(含有的杂质不溶于水且不与酸反应)的纯度。
【实验原理】2Na2CO4 + 4HCl ===== 4NaCl + 2CO2↑+ O2↑+ 2H2O
【实验装置】
【交流与讨论】
Ⅰ.甲同学认为测定产物中O2
的体积即可测定样品的纯度。
(1) 装置②的作用是: ;
(2) 装置③的作用是: ;
(3) 称取适量样品与足量浓盐酸充分反应后,收集到的氧气的体积为0.25 L(已知该实验条件下氧气的密度为1.28g/L),则称取的样品质量应大于 g;
Ⅱ.乙同学认为测定产物中CO2的质量(即反应前后装置②的质量差)就可测定样品的纯度。但利用上述实验装置测得CO2的质量并计算样品的纯度,结果会偏高,你认为原因可能是 ;(填序号)
A.浓盐酸易挥发,产生的氯化氢气体被装置②吸收
B.二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收
C.装置①、②内空气中的二氧化碳被装置②吸收
Ⅲ.丙同学提出了一种新方案,得到了大家的一致认可:称取样品12.5g,滴加足量浓盐酸至样品反应完全,再将烧瓶中所有的液体蒸发、结晶、烘干,称得氯化钠固体11.7 g。则计算该样品的纯度(写出计算过程)
【答案】(1)除去![]() (2)证明
(2)证明![]() 已除尽
已除尽
(3)2.44 (4)ABC (5)97.6%
【解析】
试题分析:Ⅰ.(1)根据实验原理2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O,要测定氧气的量,必须先除去二氧化碳、氯化氢气体等,故装置②中浓氢氧化钠的作用是除去二氧化碳和氯化氢气体;(2)装置③中澄清石灰水的作用是验证二氧化碳是否被除尽;
(3)设收集到的氧气的体积为0.25L,需要过碳酸钠的质量为x,
2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O
24432
x 0.25L×1.28g/L
![]() ,
,
x=2.44g
Ⅱ.测得二氧化碳的体积偏大,原因可能有:浓盐酸易挥发,产生的氯化氢气体被装置②吸收;二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收;装置①、②内空气中的二氧化碳被装置②吸收;
Ⅲ.设样品中过碳酸钠的质量为y,
2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O
244234
y11.7g
![]() ,y=12.2g
,y=12.2g
该样品的纯度为:![]() ×100%=97.6%
×100%=97.6%

【题目】(7分)实验室里有一瓶常用的无色溶液,因保管不当,其残缺的标签中只剩下“Na”和“10%”字样(如图所示).
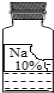
小强和小华同学很感兴趣,决定对其成分进行探究.
【提出问题】这瓶试剂可能是什么溶液呢?
【交流讨论】根据受损标签的情况判断,这瓶试剂不可能是 ( )
A.酸B.碱C.盐
【查阅资料】
Ⅰ初中常见含钠的化合物有:NaCl、NaOH、Na2CO3、NaHCO3.
ⅡNa2CO3和NaHCO3的水溶液都呈碱性.
Ⅲ室温(20℃)时,测定四种物质的溶解度数据如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
溶解度g | 36 | 109 | 215 | 9.6 |
小华根据试剂瓶标注的质量分数为10%和上表中的溶解度数据判断,这瓶试剂不可能是
【作出猜想】①可能是NaCl;②可能是Na2CO3;③可能是
【实验探究】
(1)小强用洁净的玻璃棒蘸取试液于pH试纸上,测得pH>7,则这瓶试剂不可能是
(2)小强为了检验该溶液是NaOH溶液还是Na2CO3溶液,他又进行了如下实验.
实验步骤 | 实验现象 | 结论及化学方程式 |
取少量溶液于试管中,滴加 | 产生大量气泡 | 反应的化学方程式: |
把产生的气体通入澄清的石灰水中. | 澄清的石灰水变浑浊 | 猜想②正确. 反应的化学方程式: |


