题目内容
Cu粉和木炭粉的混合物a g,在空气中充分加热至反应完全,冷却后称量剩余固体,仍为a g,则原混合物中Cu的质量分数为
A.80%
B.20%
C.64%
D.40%
解析:
|
通过分析题意知剩余固体为CuO,即CuO的质量=Cu粉的质量+木炭粉的质量.根据质量守恒定律,在反应前后Cu元素的质量不发生变化,所以反应前铜粉的质量等于CuO中Cu元素的质量,那么Cu在混合物中的质量分数就等于CuO中Cu元素的质量分数,为 |

①2CuO+C
| ||
| ||
他们想验证自已的想法,请你同他们一起进行探究.
猜想与假设
木炭粉与氧化铜反应生成的产物有三种可能:
(1)产物是铜和一氧化碳;(2)产物是铜和二氧化碳;(3)产物是
设计方案
(1)检验产物中是否有CO2的方法是
(2)如何检验产物是否存在CO,学习小组同学找查了资料:CO的特征反应是CO能使某种氯化钯的黄色混合液变蓝.
实验结论设计的实验装置(如图)

实验报告:
| 实验现象 | 实验结论 |
| ①A中固体由黑色变红色 ②B中黄色试纸变蓝 ③C中 |
①有Cu生成 ②有 ③有CO2生成 |
(1)实验结束时,为防止Cu被氧化,必须先停止加热,待Cu冷却后再将试管口的胶塞取下,因此,若没有B安全瓶,可能导致的后果是
(2)根据实验结论,从环保角度考虑,上述装置C后应添加的装置是
拓展与交流
如果用右图装置代替左图中的A装置,这样既可以排尽试管中的空气,又能将反应的气体产物都排出来,该气体应是
(13分)木炭粉还原氧化铜实验后的混合粉末中含有铜、氧化铜、少量木炭粉,实验室从该混合粉末中回收铜的方案如下:
(1)写出下列反应的化学方程式:
反应①:______________________; 反应②:___________________________.
(2)反应①所用的硫酸的质量分数为24.5%.现要配制40g 24.5%的硫酸,需________g 98%的硫酸和_______g水.
(3)在进行“反应①”、“反应②”、“反应③”的操作时,可将反应物加入__________中(填仪器名称),然后__________ (填操作名称),使反应充分进行.
(4)试剂A可选用___________溶液(填一种物质的化学式)
(5)已知某合金粉末除铝外,还含有铁、铜中的一种或两种.某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究.
【查阅资料】铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应.
【猜 想】猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有 (填名称).
猜想3:该合金粉末中除铝外,还含有铁、铜.
【实验探究】下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液.
| 实验方案 | 实现现象 | 结论 |
| ①取一定量的合金粉末,加过量的_______,充分反应后过滤,滤渣备用. | 粉末部分溶解,并有气体放出. | 合金中一定含有 . |
| ②取步骤①所得滤渣,加过量的_________,充分反应. | 滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有 . |
【反思】一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.写出铝与稀盐酸反应的化学方程式 .
(13分)木炭粉还原氧化铜实验后的混合粉末中含有铜、氧化铜、少量木炭粉,实验室从该混合粉末中回收铜的方案如下:
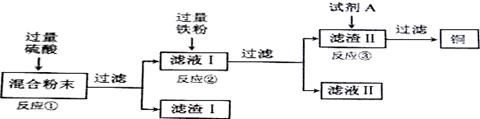
(1)写出下列反应的化学方程式:
反应①:______________________; 反应②:___________________________.
(2)反应①所用的硫酸的质量分数为24.5%.现要配制40g 24.5%的硫酸,需________g 98%的硫酸和_______g水.
(3)在进行“反应①”、“反应②”、“反应③”的操作时,可将反应物加入__________中(填仪器名称),然后__________ (填操作名称),使反应充分进行.
(4)试剂A可选用___________溶液(填一种物质的化学式)
(5)已知某合金粉末除铝外,还含有铁、铜中的一种或两种.某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究.
【查阅资料】铝与氢氧化钠溶液反应方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑( 产物NaAlO2溶于水);Fe、Cu不与氢氧化钠溶液反应.
【猜 想】猜想1:该合金粉末中除铝外,还含有铁.
猜想2:该合金粉末中除铝外,还含有 (填名称).
猜想3:该合金粉末中除铝外,还含有铁、铜.
【实验探究】下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液.
|
实验方案 |
实现现象 |
结论 |
|
①取一定量的合金粉末,加过量的_______,充分反应后过滤,滤渣备用. |
粉末部分溶解,并有气体放出. |
合金中一定含有 . |
|
②取步骤①所得滤渣,加过量的_________,充分反应. |
滤渣部分溶解,并有气体放出,溶液呈浅绿色. |
合金中一定含有 . |
【探究结论】猜想3成立.
【反思】一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质.写出铝与稀盐酸反应的化学方程式 .
小杰和小燕学习了碳单质的化学性质后,知道碳与氧气反应,若反应物的量不同,生成物不同。于是两人联想到木炭粉与氧化铜发生的反应可能有:
①C+2CuO 2Cu+CO2↑ ②C+CuO
2Cu+CO2↑ ②C+CuO Cu+CO↑
Cu+CO↑
他们想来验证自己的想法,请你和他们一起进行探究:(请完成下列空白处)
【提出问题】木碳与氧化铜反应除生成单质铜外,另一种生成物是什么?
【猜想与假设】木炭粉与氧化铜反应生成物有三种可能:
⑴产物是铜和一氧化碳 ⑵产物是铜和二氧化碳 ⑶产物是 ①▲ 。
【设计方案】
⑴检验CO2的方法是 ②▲ 。(用方程式表示)
⑵如何检验产物中是否存在CO,两位同学分别提出了检验CO的方案,但都被大家否定了。请在下表中写出不可行的原因。
检验方案 | 不可行的原因 | |
小杰 | 把小动物放在收集的气体中,观察能否存活 | ③▲ |
小燕 | 点燃生成的气体,观察能否燃烧 | ④▲ |
查阅资料后,他们把滤纸浸泡在磷钼酸与氯化钯的黄色混合液中,制成试纸(试纸遇一氧化碳立刻变蓝,而遇二氧化碳不反应)
【实验结论】设计的实验装置(如下图1):

实验现象 | 实验结论 |
A中固体由黑色变成红色 | 有Cu生成 |
B中黄色试纸变蓝 | 有 ⑤▲ 生成 |
C中 ⑥▲ | 有CO2生成 |
【反思与评价】
⑴如果A装置中的试管口高于试管底部,在实验过程中可能造成的后果是 ⑦▲ 。
⑵实验结束时,为防止铜被氧化,必须先停止加热,待铜冷却后再将试管口的橡皮塞取下,因此若没有B试剂瓶,可能导致的后果是 ⑧▲ 。
⑶根据实验结论,从环保的角度考虑,上述装置C后应添加的装置是 ⑨▲ 。
【拓展与交流】
如果用如图2装置代替图1中的A装置,这样既可以排尽试管中的空气,又能将反应产生的气体都“赶”出来,该气体可能是 ⑩▲ 。
