题目内容
【题目】小强在回家的途中经过一鱼塘边时,发现养鱼师傅向鱼塘中撒一种微黄色的固体,鱼塘中顿时产生大量气泡,经咨询得知,这种固体的主要成分是过氧化钙(CaO2),请你与小强共同探究。

(1)为研究鱼塘中大量气泡是何种气体所致,小强使用如图所示的装置进行实验,打开分液漏斗的活塞,控制滴加水的速度,观察到试管内有气泡产生,用带火星的木条靠近P处,木条复燃,说明生成的气体是______。
(2)查阅资料并根据质量守恒定律分析,小强认为过氧化钙与过量水反应还应产生一种含有钙元素的产物。开始小强猜想该产物为CaO,但通过思考他很快否定了原先的猜想,并重新猜想生成的含钙产物为Ca(OH)2。请解释小强否定原假设建立新假设的理由:_____。
请设计一个实验方案来验证小强的新假设,并填入下表空格中:
实验步骤 | 可能出现的现象 | 结论 |
____ | ____ | CaO2与H2O反应有Ca(OH)2生成 |
CaO2与H2O反应无Ca(OH)2生成 |
【答案】氧气 氧化钙与水不共存,能发生反应,产生氢氧化钙 取适量反应后的溶液于烧杯中,通入二氧化碳气体 溶液变浑浊(或有白色沉淀产生)
【解析】
(1)氧气具有助燃性,用带火星的木条靠近P处,木条复燃,说明生成的气体是氧气;
(2)解释小强否定原假设建立新假设的理由:氧化钙与水不共存,能发生反应,产生氢氧化钙;水和氧化钙反应原理:CaO+H2O=Ca(OH)2;
实验步骤 | 可能出现的现象 | 结论 |
取适量反应后的溶液于烧杯中,通入二氧化碳气体 | 溶液变浑浊(或有白色沉淀产生) | CaO2与H2O反应有Ca(OH)2生成 |
CaO2与H2O反应无Ca(OH)2生成 |
用二氧化碳气体检验氢氧化钙溶液的反应原理:CO2+Ca(OH)2=CaCO3↓+H2O。

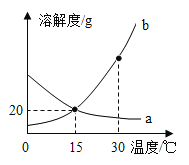
【题目】将20.0g稀盐酸逐滴加入到10.0g溶质质量分数为40%的氢氧化钠溶液中,边滴加边搅拌,随着稀盐酸的滴加,溶液的pH变化情况如图所示,溶液的温度变化如表所示(不考虑反应过程中热量散失)
反应时间(s) | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
溶液温度(℃) | 20.5 | 20.6 | 20.7 | 20.8 | 20.9 | 20.8 | 20.7 |
(1)当稀盐酸与氢氧化钠溶液恰好完全反应时,溶液的温度是_____℃
(2)计算稀盐酸中溶质的质量分数_________(精确到0.1%)