题目内容
11.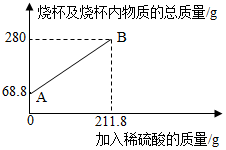 为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉未于质量为51.8克的烧杯中,然后逐步加入一定质量分数的稀硫酸,当加入211.8g稀硫酸时恰好完全反应,加入稀硫酸的质量与烧杯及烧杯内物质的总质量的关系如图.
为测定某碳素钢样品中铁的质量分数,现取一定质量的样品粉未于质量为51.8克的烧杯中,然后逐步加入一定质量分数的稀硫酸,当加入211.8g稀硫酸时恰好完全反应,加入稀硫酸的质量与烧杯及烧杯内物质的总质量的关系如图.(1)该实验取用的样品质量为17g.
(2)求样品中铁的质量分数;反应后所得溶液中的溶质的质量分数.(写出计算过程,结果保留一位小数)
分析 根据图中可以看出,没加入硫酸时烧杯中物质的总质量为68.8g,而烧杯自重为51.8g,可知样品的质量为68.8g-51.8g=17g.根据质量守恒定律可知,过程中质量的减少是因为生成了氢气,所以可以求算氢气的质量,根据氢气和对应的化学方程式求算铁和硫酸亚铁的质量,进而求算对应的质量分数.
解答 解:图中没加入硫酸时的总质量为68.8g,而烧杯的质量为51.8g,可知样品的质量为68.8g-51.8g=17g.
根据质量守恒定律可得,生成的氢气的质量为68.8g+211.8g-280g=0.6g
设参加反应的铁的质量为x,生成的硫酸亚铁的质量为y
Fe+H2SO4=FeSO4+H2↑
56 152 2
x y 0.6g
$\frac{56}{x}$=$\frac{152}{y}$=$\frac{2}{0.6g}$
x=16.8g
y=45.6g
则样品中铁的质量分数为$\frac{16.8g}{17g}$×100%≈98.8%;反应后所得溶液中的溶质的质量分数$\frac{45.6g}{16.8g+211.8g-0.6g}$×100%=20.0%
答:(1)该实验取用的样品质量为 17g.
(2)样品中铁的质量分数为98.8%;反应后所得溶液中的溶质的质量分数为20.0%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
1.鉴别氧气,一氧化碳,二氧化碳三种气体,可行简便的方法是( )
| A. | 通入澄清的石灰水 | B. | 通入紫色的石蕊试液 | ||
| C. | 比较三种物质的溶解性 | D. | 用燃烧的木条 |
16.在一定条件下,下列物质在密闭容器内充分反应,测得反应前后各物质的质量如下:
则该反应的化学方程式为( )
| 物质 | C2H2 | O2 | H2O | CO2 | CO |
| 反应前质量/g | 2.6 | 7.2 | 0.2 | 0.4 | 0 |
| 反应后质量/g | 待测 | 0 | 2.0 | 7.0 | 1.4 |
| A. | C2H2+2 O2$\frac{\underline{\;点燃\;}}{\;}$H2O+CO2+CO | B. | C2H2+7 O2$\frac{\underline{\;点燃\;}}{\;}$4H2O+2CO2+6CO | ||
| C. | 4C2H2+9 O2$\frac{\underline{\;点燃\;}}{\;}$4H2O+6CO2+2CO | D. | 5C2H2+12 O2$\frac{\underline{\;点燃\;}}{\;}$5H2O+9CO2+CO |
6.能使无色酚酞溶液变红色的溶液,能使紫色石蕊溶液( )
| A. | 变红色 | B. | 变蓝色 | C. | 变无色 | D. | 不变色 |
4.通过实验得出“空气是由氧气和氮气组成的”这一结论的科学家是( )
| A. | 普利斯特里 | B. | 舍勒 | C. | 卡文迪许 | D. | 拉瓦锡 |