题目内容
课外活动小组的同学在测定某品牌苏打(主要成分是Na2CO3)中Na2CO3质量分数,进行了以下实验:取12g苏打粉,放在一个容器中,然后加入100g稀盐酸,杂质不与稀盐酸反应.将每隔相同时间称得剩余物质量与时间实验数据关系见下表:
友情提示:该反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑
请分析表中数据回答并计算(第3小题要求写出计算过程)
(1)12g苏打粉和足量稀盐酸反应,最多生成二氧化碳气体的质量为
(2)m为
(3)原苏打中含Na2CO3的质量分数是多少?(精确到0.1%)
| 时间 | t0 | t1 | t2 | t3 | t4 |
| 剩余物体的质量g | 112 | 110g | 108g | 107.6g | m |
请分析表中数据回答并计算(第3小题要求写出计算过程)
(1)12g苏打粉和足量稀盐酸反应,最多生成二氧化碳气体的质量为
4.98
4.98
g.(2)m为
107.6
107.6
g.(3)原苏打中含Na2CO3的质量分数是多少?(精确到0.1%)
分析:(1)根据题意,当12g苏打粉全部是碳酸钠时,和足量稀盐酸反应,生成二氧化碳气体的质量为最多,根据反应的方程式,可求出二氧化碳气体的质量;
(2)取12g苏打粉与100g稀盐酸反应,根据实验结果数据表,在相同的时间内,固体减少的质量应是2g,而在t2到t3时间内只减少了0.4g,说明此时Na2CO3已完全反应,剩余固体的质量不再减少,由此可知m的值;
(3)由二氧化碳的质量,根据反应的方程式,可求出碳酸钠的质量,即可求出原苏打中含Na2CO3的质量分数.
(2)取12g苏打粉与100g稀盐酸反应,根据实验结果数据表,在相同的时间内,固体减少的质量应是2g,而在t2到t3时间内只减少了0.4g,说明此时Na2CO3已完全反应,剩余固体的质量不再减少,由此可知m的值;
(3)由二氧化碳的质量,根据反应的方程式,可求出碳酸钠的质量,即可求出原苏打中含Na2CO3的质量分数.
解答:解:(1)设当12g苏打粉全部是碳酸钠时,和足量稀盐酸反应,生成二氧化碳气体的质量为x
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
12g x
=
x=4.98g
所以,12g苏打粉和足量稀盐酸反应,最多生成二氧化碳气体的质量为4.98g
(2)根据实验结果数据表,在相同的时间内,固体减少的质量应是2g,而在t2到t3时间内只减少了0.4g,说明此时Na2CO3已完全反应,剩余固体的质量不再减少,所以,m的值是107.6g;
(3)设Na2CO3的质量是y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
y 4.4 g
=
y=10.6g
原苏打中含Na2CO3的质量分数是:
× 100%=88.3%
故答为:(1)4.98;(2)107.6;(3)原苏打中含Na2CO3的质量分数是88.3%.
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
12g x
| 106 |
| 44 |
| 12g |
| x |
所以,12g苏打粉和足量稀盐酸反应,最多生成二氧化碳气体的质量为4.98g
(2)根据实验结果数据表,在相同的时间内,固体减少的质量应是2g,而在t2到t3时间内只减少了0.4g,说明此时Na2CO3已完全反应,剩余固体的质量不再减少,所以,m的值是107.6g;
(3)设Na2CO3的质量是y
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 44
y 4.4 g
| 106 |
| 44 |
| y |
| 4.4g |
原苏打中含Na2CO3的质量分数是:
| 10.6g |
| 12g |
故答为:(1)4.98;(2)107.6;(3)原苏打中含Na2CO3的质量分数是88.3%.
点评:本题考查根据化学方程式进行计算,要想解答好这类题目,首先,要理解和熟记根据化学反应方程式的计算步骤和格式,以及与之相关的知识等,进行认真地选择或解答,本题关键是判断反应是否完全.

练习册系列答案
相关题目
课外活动小组的同学在测定由NaCl和Na2CO3形成的固体混合物组成时,进行了以下实验:取40g固体混合物配成溶液,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见下表:
请分析表中数据回答并计算.
(1)m= g.
(2)原固体混合物中Na2CO3的质量分数是多少? .
| 实验一 | 实验二 | 实验三 | 实验四 | |
| 原固体混合物质量 | 10g | 10g | 10g | 10g |
| 加入CaCl2溶液质量 | 10g | 20g | 30g | 40g |
| 生成的沉淀的质量 | 2g | m | 5g | 5g |
(1)m=
(2)原固体混合物中Na2CO3的质量分数是多少?
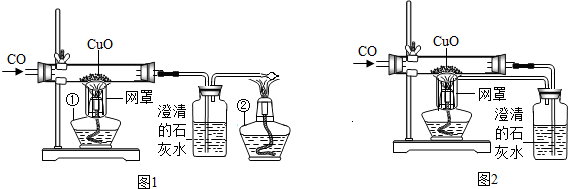
 某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分Fe2O3)炼铁的主要反应原理.他们设计的实验装置,如图:
某校课外活动小组的同学在老师的帮助下,探究用赤铁矿(主要成分Fe2O3)炼铁的主要反应原理.他们设计的实验装置,如图: