题目内容
10. 如图是关于铁化学性质的知识网络(“→”表示一种物质转化为另一种物质).其中B是密度最小的气体,C为红色固体单质,请回答下列问题:
如图是关于铁化学性质的知识网络(“→”表示一种物质转化为另一种物质).其中B是密度最小的气体,C为红色固体单质,请回答下列问题:(1)C物质的化学式为Cu.
(2)B物质的一种用途是作燃料.
(3)反应②还需要的一种反应物是CO(填化学式).
(4)写出④反应的化学方程式:Fe+H2SO4=FeSO4+H2↑.
(5)反应①导致每年有大量的钢铁锈蚀,为阻止该反应的发生,人们常采用在钢铁表面涂刷油漆或镀上其它金属等方法.这两种方法的共同原理是阻止钢铁与氧气和水接触.
分析 解题时往往需要从题目中挖出一些明显或隐含的条件,找出题中的“题眼”即突破口,抓住突破口,导出结论,最后别忘了把结论代入原题中验证,若“路”走得通则已经成功.“密度最小的气体”为氢气,则气体B为氢气;“紫红色固体单质”C是铜;结合转化关系图可知:由铁而转化成红色固体单质C为铜,氧化铁可被一氧化碳还原为铁,铁与酸反应可生成氢气;铁生锈的条件是铁与氧气和水同时接触.
解答 解:
(1)铜是红色固体单质,故C是铜,即反应③是由铁而转化为铜,“曾青得铁则化为铜”,把铁放入可溶性的铜盐溶液(如硫酸铜溶液、氯化铜溶液等)中就能置换出铜,故C物质的化学式为Cu;
(2)密度最小的气体为氢气,则气体B为氢气,由于氢气具有可燃性,所以可用做燃料;另外氢气具有还原性,所以可用于冶炼金属;由于密度最小,所以可充填探空气球;
故B物质为氢气,其一种用途是作燃料;
(3)Fe2O3可被一氧化碳、碳、氢气等在加热的条件下还原为铁,故可填:CO;
(4)密度最小的气体为氢气,则气体B为氢气,反应④是由铁转化成氢气,可以通过铁与稀酸(常用的是稀盐酸和稀硫酸)的反应来实现,故答案为:Fe+H2SO4=FeSO4+H2↑;(5)铁生锈的条件是铁与氧气和水同时接触,所以防止铁生锈的原理就是使铁隔绝氧气和水,故可填:氧气和水.
故答案为:
(1)Cu;
(2)作燃料(或还原剂);
(3)CO;
(4)Fe+H2SO4=FeSO4+H2↑;
(5)氧气和水.
点评 在学习中要求学生要熟记一些物质的性质,并能根据性质判断属于哪种物质.如根据密度最小判断是氢气,根据红色金属单质判断是铜.

练习册系列答案
相关题目
1.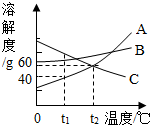 如图是A、B、C三种物质的溶解度曲线,下列说法错误的是( )
如图是A、B、C三种物质的溶解度曲线,下列说法错误的是( )
 如图是A、B、C三种物质的溶解度曲线,下列说法错误的是( )
如图是A、B、C三种物质的溶解度曲线,下列说法错误的是( )| A. | t1℃时,A、B、C三种物质的溶解度由大到小的顺序是C>B>A | |
| B. | A可以采用冷却热饱和溶液的方法结晶 | |
| C. | t2℃时,A、C两种溶液的溶解度相等 | |
| D. | t2℃时,A、C两种溶液的溶质质量分数一定相等 |
5.实验室开放日,老师给某化学兴趣小组一包氧化铜的混合物样品,要求兴趣小组测定样品中氧化铜的质量分数.同学们称取5g样品于烧杯中,再把20g稀硫酸平均分四次加入到烧杯中并进行搅拌,让其充分反应.有关实验数据记录如下:
求:
(1)氧化铜中铜元素和氧元素的质量比为4:1.
(2)硫酸分子中各原子的个数比H:S:O=2:1:4.
(3)样品中铜的质量为3g.
(4)第4次反应后所得溶液中硫酸铜的质量分数.
| 实验次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| 加入的稀硫酸的质量/g | 5 | 5 | 5 | 5 |
| 烧杯中剩余固体的质量/g | 4.2 | 3.4 | 3.0 | 3.0 |
(1)氧化铜中铜元素和氧元素的质量比为4:1.
(2)硫酸分子中各原子的个数比H:S:O=2:1:4.
(3)样品中铜的质量为3g.
(4)第4次反应后所得溶液中硫酸铜的质量分数.
15.下列关于微观粒子的说法正确的是( )
| A. | 原子在化学变化中不能够再分 | |
| B. | 分子之间有间隔,原子之间没有间隔 | |
| C. | 只有分子、原子能构成物质 | |
| D. | 分子比原子大 |
2.如表列出了除去物质中所含少量杂质的方法,其中正确的是( )
| 选项 | 物质 | 所含杂质 | 除去杂质的方法 |
| A | NaOH | NaCl | 加入适量的稀盐酸 |
| B | FeCl2 | CuCl2 | 加入过量铁粉、充分反应后过滤 |
| C | KCl | MnO2 | 加水溶解、过滤、洗涤、干燥 |
| D | Na2SO4 | H2SO4 | 加过量的碳酸钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
 A、B、C、D、E是初中化学常见的五种不同类别的物质,其中A是导致“温室效应”的-种气体,C是一种黑色粉末.图中“--”表示相连的物质在一定条件下可以发生反应,“→”表示物质间存在转化关系.(1)物质B可能是盐酸;它的一种用途是金属除锈.(2)D与E反应的化学方程式为2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,其基本反应类型是复分解反应.
A、B、C、D、E是初中化学常见的五种不同类别的物质,其中A是导致“温室效应”的-种气体,C是一种黑色粉末.图中“--”表示相连的物质在一定条件下可以发生反应,“→”表示物质间存在转化关系.(1)物质B可能是盐酸;它的一种用途是金属除锈.(2)D与E反应的化学方程式为2NaOH+CuSO4=Cu(OH)2↓+Na2SO4,其基本反应类型是复分解反应.