题目内容
(2013?历下区二模)已知某碳酸钠样品中含有少量的氯化钠杂质,化学兴趣小组为测定该碳酸钠样品的纯度,设计了如图所示的实验:
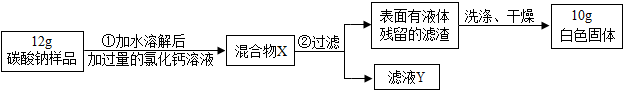
(1)在第 ①步操作中观察到的明显现象是
(2)滤液Y中的溶质是
(3)若过程 ①所加氯化钙溶液的量不足,则计算出的碳酸钠样品的纯度将
(4)根据实验数据,计算样品中碳酸钠的质量(计算结果精确到0.1克).

(1)在第 ①步操作中观察到的明显现象是
有白色沉淀生成
有白色沉淀生成
.(2)滤液Y中的溶质是
氯化钠和氯化钙
氯化钠和氯化钙
.(3)若过程 ①所加氯化钙溶液的量不足,则计算出的碳酸钠样品的纯度将
偏小
偏小
(填“偏大”、“偏小”或“不受影响”).(4)根据实验数据,计算样品中碳酸钠的质量(计算结果精确到0.1克).
分析:根据题目给出的流程图和信息:当加入过量的氯化钙溶液时,碳酸钠和氯化钙反应生成碳酸钙白色沉淀和氯化钠,因此滤渣是碳酸钙,滤液Y中的溶质是氯化钠和氯化钙;若过程①所加氯化钙溶液的量不足,则计算出的碳酸钠样品的纯度将偏小,因为碳酸钠会有剩余;根据白色固体碳酸钙是10g,可以求出碳酸钠的质量,然后根据质量分数公式求碳酸钠的质量分数.
解答:解:(1)当加入过量的氯化钙溶液时,碳酸钠和氯化钙反应生成碳酸钙白色沉淀和氯化钠,故答案为:有白色沉淀生成
(2)当加入过量的氯化钙溶液时,碳酸钠和氯化钙反应生成碳酸钙白色沉淀和氯化钠,因此滤液Y中的溶质是氯化钠和氯化钙,故答案为:氯化钠和氯化钙
(3)若过程①所加氯化钙溶液的量不足,则计算出的碳酸钠样品的纯度将偏小,因为碳酸钠会有剩余故答案为:偏小
(4)设碳酸钠的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
x 10g
=
x=10.6g
×100%≈88.3% 答:碳酸钠的质量分数是88.3%.
故答案为:88.3%
(2)当加入过量的氯化钙溶液时,碳酸钠和氯化钙反应生成碳酸钙白色沉淀和氯化钠,因此滤液Y中的溶质是氯化钠和氯化钙,故答案为:氯化钠和氯化钙
(3)若过程①所加氯化钙溶液的量不足,则计算出的碳酸钠样品的纯度将偏小,因为碳酸钠会有剩余故答案为:偏小
(4)设碳酸钠的质量为x
Na2CO3+CaCl2=CaCO3↓+2NaCl
106 100
x 10g
| 106 |
| 100 |
| x |
| 10g |
| 10.6g |
| 12g |
故答案为:88.3%
点评:本题属于实验探究题,有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用最少的药品和最简单的方法;有关的计算要准确,本考点主要出现在填空题和实验题中.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 (2013?历下区二模)铅蓄电池是一种化学电源,它的正负极分别是浸在稀硫酸中的未知物质X和铅(Pb),充电和放电的反应过程如图所示.下列说法中不正确的是( )
(2013?历下区二模)铅蓄电池是一种化学电源,它的正负极分别是浸在稀硫酸中的未知物质X和铅(Pb),充电和放电的反应过程如图所示.下列说法中不正确的是( )