题目内容
甲、乙、丙三位同学为一家化工厂的污水设计排污方案,请你就他们的探究过程回答有关问题.
Ⅰ.首先用pH试纸检测污水的酸碱性.三位同学分别进行如下实验:
甲:取pH试纸于玻璃片上,用玻璃棒蘸取待测液滴在pH试纸上,测得pH<7;
乙:取pH试纸于玻璃片上,先用蒸馏水湿润,再用玻璃棒蘸取待测液滴在pH试纸上,测得pH<7;
丙:取pH试纸直接浸入待测液中,测得pH<7.
(1)以上三位同学中操作规范的是________,污水显______(填写“酸性”、“碱性”或“中性”).
Ⅱ.利用中和反应原理测定污水中污染物(假设污染物为硫酸)的质量分数.
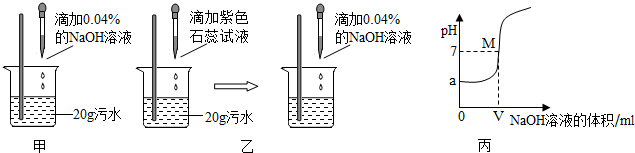
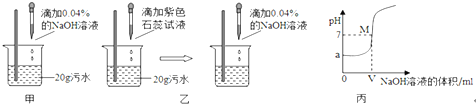
甲、乙两同学设计的方案如图甲、乙所示:

(2)甲同学取少量反应后的溶液于试管中,滴加几滴无色酚酞试液,酚酞呈红色,于是得出
“两种物质已恰好中和”的结论.你认为他的结论是否正确?________,理由是_____________.
(3)乙同学当观察到溶液由红色变成紫色现象时即认为两者恰好完全反应,发生的化学反应方程式为__________________________________________;若此时消耗NaOH溶液4g,则污水中硫酸的质量分数为_______%.(写出计算过程)
(4)实验过程中,NaOH溶液必须用胶头滴管逐滴加入,且要用玻璃棒不断搅拌,目的是
____________________________________________.
(5)丙同学利用连线在传感器上的计算机随机绘制出了如图丙所示的溶液的pH随所加的 的NaOH溶液体积变化的曲线.从曲线上可知污水的pH=______,M点表示的含义是 __________________,此时溶液中的溶质是_______.
(6)为了除去污水中的硫酸,你建议选用的原料是____________(填写序号).
A.NaOH B.Ca(OH)2 C.CuO D.Fe.
民以食为天,食以安为先.食品安全一直是人们关注的热点问题,现在许多食品都采用密封包装,但包装袋内的空气、水蒸气仍然会使食品氧化、受潮而变质,因此一些食品包装袋中需放入一些脱氧剂,以使食品的保质期更长一些.荆门某校课题研究小组甲、乙、丙三位同学为探究“脱氧剂”的成分,从月饼包装袋中取出“脱氧剂”,打开封口,将其倒在滤纸上,观察到“脱氧剂”为黑色粉末,其中还夹杂着少量红色粉末.
提出问题:该“脱氧剂”中的黑色、红色粉末各是什么?
查阅资料:铁粉为黑色,易与空气中的氧气、水反应生成红色的铁锈;铁能被磁铁吸引而铜不能,含Fe3+的水溶液呈棕黄色;铜粉为红色,氧化铜为黑色.
作出猜想:甲同学认为:黑色粉末可能是氧化铜,红色粉末可能是铜;
乙同学认为:黑色粉末可能是铁粉,也可能含有少量的活性碳粉;红色物质是氧化铁;
丙同学认为:黑色物质可能是氧化铜,活性碳粉;红色物质可能是铜.你认为______同学的猜想正确,理由是______.
设计方案与实验验证:设计一个实验方案来验证该同学的猜想是正确的,请填写以下实验报告:
| 实验步骤 | 实验现象 | 结论 |
| (1)用磁铁充分接触滤纸上的“脱氧剂“粉末 | 大部分黑色粉末被吸引 | ①______ |
| (2)将红色的物质放入小试管中,加入足量稀硫酸,观察现象 | ②______ | 红色物质是氧化铁 |
拓展分析:你认为能作食品“脱氧剂“的物质必须具备什么性质?______.