题目内容
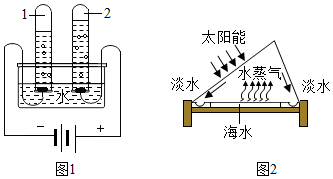
20.如图实验基本操作错误的是( )| A. |  检查装置气密性 | B. |  滴加液体 | C. |  过滤 | D. |  点燃酒精灯 |
分析 根据常见仪器的使用方法和注意事项,实验基本操作的正确操作方法回答本题.
解答 解:A、检查装置的气密性时,先将导管放入水中,用手握住试管,导管口有气泡冒出,装置气密性良好,正确;
B、用胶头滴管滴加液体时,胶头滴管悬空放在试管正上方,正确;
C、过滤液体时,要注意“一贴、二低、三靠”的原则,正确;
D、点燃酒精灯不能引燃,要用火柴点燃,错误.
故选D.
点评 化学实验的基本操作是做好化学实验的基础,学生要在平时的练习中多操作,掌握操作要领,使操作规范.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
10.活性氧化锌(ZnO) 是一种面向21世纪的新型高功能精细无机产品,近几年有关该物质的制备成为化工行业研究的热点.某校化学兴趣小组的同学参观了某厂用粗ZnO制备活性ZnO的生产流程,做如下探究.
Ⅰ、制备活性氧化锌
一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如图1:

【查阅资料】①、粗ZnO中常含杂质FeO、CuO
②、反应3是为了制得碱式碳酸锌、碱式碳酸锌经焙烧可制得活性ZnO
③、已知:几种物质沉淀时的pH如下表:
请问答下列问题:
(1)溶解前将氧化锌粗品粉碎成细颗粒,目的是增大反应物的接触面积或加快溶解速率.
(2)写出在粗ZnO样品中加硫酸发生反应的化学方程式ZnO+H2SO4═ZnSO4+H2O(选写一个).
(3)反应1的目的是将Fe2+氧化为Fe3+,并完全沉淀Fe(OH)3,为了暂不形成Cu(OH)2、Zn (OH)2,该步骤需控制溶液pH的范围是3.2~5.2.
(4)操作A的名称是过滤,该过程中使用的玻璃仪器有烧杯、玻璃棒、漏斗.
(5)反应2中加入锌发生的反应属于置换反应(填化学反应的基本类型).
(6)B溶液的溶质是(NH4)2SO4,检验其中是否含NH4+ 的方法为可加入NaOH浓溶液加热,观察现象,如有刺激性气味的气体生成,则说明含有NH4+.
Ⅱ、测定碱式碳酸锌的化学式
该兴趣小组的同学欲写出上述流程中碱式碳酸锌焙烧生成氧化锌的化学方程式,但不知道碱式碳酸锌的化学式(xZnCO3•yZn(OH)2•zH2O),于是从该厂带回部分焙烧前的碱式碳酸锌样品在老师的指导下完成下列实验.
用下列装置测定碱式碳酸锌的化学组成,计算xZnCO3•yZn(OH)2•zH2O中x:y:z的最简比.(假设每步反应、吸收均完全)
【实验步骤】
①按图2连接好装置,并检查装置的气密性检查装置的气密性;
②在热分解装置中装入68.2g样品,打开活塞打开K1K2,,关闭K3,缓缓鼓入空气数分钟; ③称量装置C、D的质量;④关闭活塞K1,K2,打开K3,打启动热分解装置,使样品充分热解;⑤停止加热,继续通空气至装置冷却到室温; ⑥再次分别称量装置C、D的质量.
[进行实验]该小组同学按上述实验步骤进行实验,并记录了如下数据:
【实验分析及数据处理】:
(1)A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是吸收空气中的水和二氧化碳.
(2)第⑤步继续通空气的目的是把产生的气体全部推入C、D中使之被完全吸收.
(3)老师在审阅方案后指出应该在E处再增加一套装置,你认为所加仪器名称是干燥管,,仪器中药品是碱石灰,其作用是防止空气中的水和二氧化碳进入D中,若没有此装置,测得二氧化碳的质量偏大(填“偏大”、“偏小”或“无影响”).
(4)根据上述数据,计算xZnCO3•yZn(OH)2•zH2O中x:y:z的最简比=1:2:1,
并写出计算过程.
提示:①xZnCO3•yZn(OH)2•zH2O受热分解为ZnO、H2O、CO2 三种产物,其中
ZnCO3 $\frac{\underline{\;\;△\;\;}}{\;}$ZnO+CO2↑
Zn(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ZnO+H2O
②可能用到的相对分子量:ZnCO3125 Zn(OH)2 99 ZnO 81 H2O 18 CO244
该碱式碳酸锌受热分解的化学方程式为ZnCO3•2Zn(OH)2•H2O $\frac{\underline{\;\;△\;\;}}{\;}$3ZnO+3H2O+CO2↑.
Ⅰ、制备活性氧化锌
一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如图1:

【查阅资料】①、粗ZnO中常含杂质FeO、CuO
②、反应3是为了制得碱式碳酸锌、碱式碳酸锌经焙烧可制得活性ZnO
③、已知:几种物质沉淀时的pH如下表:
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
| Fe(OH)2是一种絮状沉淀,不易除去,处理时常将其转化为Fe(OH)3而除去. | ||||
(1)溶解前将氧化锌粗品粉碎成细颗粒,目的是增大反应物的接触面积或加快溶解速率.
(2)写出在粗ZnO样品中加硫酸发生反应的化学方程式ZnO+H2SO4═ZnSO4+H2O(选写一个).
(3)反应1的目的是将Fe2+氧化为Fe3+,并完全沉淀Fe(OH)3,为了暂不形成Cu(OH)2、Zn (OH)2,该步骤需控制溶液pH的范围是3.2~5.2.
(4)操作A的名称是过滤,该过程中使用的玻璃仪器有烧杯、玻璃棒、漏斗.
(5)反应2中加入锌发生的反应属于置换反应(填化学反应的基本类型).
(6)B溶液的溶质是(NH4)2SO4,检验其中是否含NH4+ 的方法为可加入NaOH浓溶液加热,观察现象,如有刺激性气味的气体生成,则说明含有NH4+.
Ⅱ、测定碱式碳酸锌的化学式
该兴趣小组的同学欲写出上述流程中碱式碳酸锌焙烧生成氧化锌的化学方程式,但不知道碱式碳酸锌的化学式(xZnCO3•yZn(OH)2•zH2O),于是从该厂带回部分焙烧前的碱式碳酸锌样品在老师的指导下完成下列实验.
用下列装置测定碱式碳酸锌的化学组成,计算xZnCO3•yZn(OH)2•zH2O中x:y:z的最简比.(假设每步反应、吸收均完全)
【实验步骤】
①按图2连接好装置,并检查装置的气密性检查装置的气密性;
②在热分解装置中装入68.2g样品,打开活塞打开K1K2,,关闭K3,缓缓鼓入空气数分钟; ③称量装置C、D的质量;④关闭活塞K1,K2,打开K3,打启动热分解装置,使样品充分热解;⑤停止加热,继续通空气至装置冷却到室温; ⑥再次分别称量装置C、D的质量.
[进行实验]该小组同学按上述实验步骤进行实验,并记录了如下数据:
| 装置C的质量(/g) | 装置D的质量(/g) | |
| 实验前 | 198.4 | 235.7 |
| 实验后 | 209.2 | 244.5 |
(1)A处干燥管盛放的药品是碱石灰(CaO与NaOH的固体混合物),其作用是吸收空气中的水和二氧化碳.
(2)第⑤步继续通空气的目的是把产生的气体全部推入C、D中使之被完全吸收.
(3)老师在审阅方案后指出应该在E处再增加一套装置,你认为所加仪器名称是干燥管,,仪器中药品是碱石灰,其作用是防止空气中的水和二氧化碳进入D中,若没有此装置,测得二氧化碳的质量偏大(填“偏大”、“偏小”或“无影响”).
(4)根据上述数据,计算xZnCO3•yZn(OH)2•zH2O中x:y:z的最简比=1:2:1,
并写出计算过程.
提示:①xZnCO3•yZn(OH)2•zH2O受热分解为ZnO、H2O、CO2 三种产物,其中
ZnCO3 $\frac{\underline{\;\;△\;\;}}{\;}$ZnO+CO2↑
Zn(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$ZnO+H2O
②可能用到的相对分子量:ZnCO3125 Zn(OH)2 99 ZnO 81 H2O 18 CO244
该碱式碳酸锌受热分解的化学方程式为ZnCO3•2Zn(OH)2•H2O $\frac{\underline{\;\;△\;\;}}{\;}$3ZnO+3H2O+CO2↑.
11.推理是化学学习中常用的思维方法.下列推断不正确的是( )
| A. | 碱溶液一定呈碱性,呈碱性的溶液不一定是碱溶液 | |
| B. | 置换反应一定有单质和化合物生成,有单质和化合物生成的反应不一定是置换反应 | |
| C. | 酸雨一定呈现酸性,呈现酸性的雨不一定是酸雨 | |
| D. | 单质一定是含一种元素的纯净物,纯净物含有一种元素不一定是单质 |
5.用嘴吹灭燃着的生日蜡烛,利用的主要灭火原理是( )
| A. | 隔绝空气 | B. | 降低可燃物的着火点 | ||
| C. | 使可燃物温度降到着火点以下 | D. | 消除可燃物 |
12.有关溶液的说法正确的是( )
| A. | 具有均一性、稳定性的液体一定是溶液 | |
| B. | 配制溶液时,搅拌可以增大固体溶质的溶解量 | |
| C. | 饱和溶液就是不能再溶解任何物质的溶液 | |
| D. | 溶液都是由溶质和溶剂组成的 |
9.硼氢化钠(化学式为NaBH4,其中氢元素的化合价为-1)是一种安全车载氢源,有关硼氢酸钠的说法正确的是( )
| A. | 含4个氢原子 | B. | 硼元素的化合价为+3 | ||
| C. | 只含一种非金属元素 | D. | Na、B、H的质量比为1:1:4 |

 由分子构成的甲、乙、丙三种物质转化关系如图所示,甲和丙是氧化物,乙为单质,甲通过光合作用可得到乙,丙的相对分子质量最小,则甲的化学式为CO2,b、d两反应的化学方程式分别为2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2.
由分子构成的甲、乙、丙三种物质转化关系如图所示,甲和丙是氧化物,乙为单质,甲通过光合作用可得到乙,丙的相对分子质量最小,则甲的化学式为CO2,b、d两反应的化学方程式分别为2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2.