题目内容
某兴趣小组同学对实验室制备氧气的条件进行如下探究实验.
①为探究MnO2、CuO、KMnO4对氯酸钾分解速度的影响,甲设计以下对比实验:
Ⅰ.将2.45g KClO3加热至质量不再改变
Ⅱ.将2.45g KClO3与1.0g MnO2均匀混合加热至质量不再改变
Ⅲ.将xg KClO3与1.0g CuO均匀混合加热至质量不再改变
Ⅳ.将2.45g KClO3与1.0gKMnO4均匀混合加热至质量不再改变
在相同温度下加热至完全反应,比较四组实验产生O2的多少及快慢,记录如下:
Ⅱ中反应的符号表达式是
②从Ⅱ反应后的产物中回收MnO2(已知两种固体剩余物中只有MnO2不溶于水),其步骤是:溶解、
③Ⅳ中除了氯酸钾分解速度比较快其产生氧气的量也比较多,请你回答下列问题:
a.用反应的符号表达式写出产生氧气多出的原因是:
b.分解速度比较快的原因是:
A.KMnO4是该反应的催化剂 B.KMnO4分解生成的MnO2是该反应的催化剂
④KMnO4是由
①为探究MnO2、CuO、KMnO4对氯酸钾分解速度的影响,甲设计以下对比实验:
Ⅰ.将2.45g KClO3加热至质量不再改变
Ⅱ.将2.45g KClO3与1.0g MnO2均匀混合加热至质量不再改变
Ⅲ.将xg KClO3与1.0g CuO均匀混合加热至质量不再改变
Ⅳ.将2.45g KClO3与1.0gKMnO4均匀混合加热至质量不再改变
在相同温度下加热至完全反应,比较四组实验产生O2的多少及快慢,记录如下:
| 反应时间 | 收到O2体积 | |
| Ⅰ | 6000s | 4.3mL |
| Ⅱ | 60s | 4.3mL |
| Ⅲ | 180s | 4.3mL |
| Ⅳ | 70s | 4.8mL |
2KClO3
2KCl+3O2↑
| ||
| △ |
2KClO3
2KCl+3O2↑
;Ⅲ中x的值应为
| ||
| △ |
2.45
2.45
.②从Ⅱ反应后的产物中回收MnO2(已知两种固体剩余物中只有MnO2不溶于水),其步骤是:溶解、
过滤
过滤
、洗涤干燥.③Ⅳ中除了氯酸钾分解速度比较快其产生氧气的量也比较多,请你回答下列问题:
a.用反应的符号表达式写出产生氧气多出的原因是:
2KMnO4
K2MnO4+MnO2+O2↑
| ||
2KMnO4
K2MnO4+MnO2+O2↑
.
| ||
b.分解速度比较快的原因是:
B
B
.(填序号)A.KMnO4是该反应的催化剂 B.KMnO4分解生成的MnO2是该反应的催化剂
④KMnO4是由
三
三
种元素组成,其相对分子质量是158
158
.分析:①根据反应方程式的书写方法和对照试验的设计方法考虑;②根据不溶于液体的固体和液体分离的方法考虑;③a因为高锰酸钾加热能产生氧气,再根据方程式的书写方法写出方程式;b.分解速度比较快的原因是高锰酸钾分解产生的二氧化锰正好作为氯酸钾分解的催化剂;④根据元素种类的识别和相对分子质量的计算方法考虑.
解答:解:①氯酸钾分解的反应物是氯酸钾,生成物是氯化钾和氧气,用最小公倍数法配平,氧气后面标上上升符号,所以方程式是:2KClO3
2KCl+3O2↑;在设计对照实验时,只能允许一个变量,所以氯酸钾的质量都相同,所以X值是2.45;
②不溶于液体的固体和液体分离的方法是过滤;
③a.因为高锰酸钾加热能产生氧气,反应物是高锰酸钾,生成物是锰酸钾、二氧化锰和氧气,用观察法配平,氧气后面标上上升符号,所以方程式是:2KMnO4
K2MnO4+MnO2+O2↑;
b.分解速度比较快的原因是高锰酸钾分解产生的二氧化锰正好作为氯酸钾分解的催化剂;
④KMnO4是由钾、锰、氧三种元素组成,相对分子质量是:39+55+16×4=158.
故答案为:①2KClO3
2KCl+3O2↑;2.45;②过滤;③2KMnO4
K2MnO4+MnO2+O2↑;B;④三;158.
| ||
| △ |
②不溶于液体的固体和液体分离的方法是过滤;
③a.因为高锰酸钾加热能产生氧气,反应物是高锰酸钾,生成物是锰酸钾、二氧化锰和氧气,用观察法配平,氧气后面标上上升符号,所以方程式是:2KMnO4
| ||
b.分解速度比较快的原因是高锰酸钾分解产生的二氧化锰正好作为氯酸钾分解的催化剂;
④KMnO4是由钾、锰、氧三种元素组成,相对分子质量是:39+55+16×4=158.
故答案为:①2KClO3
| ||
| △ |
| ||
点评:解答本题关键是要知道方程式的书写方法,催化剂的特点,熟悉相对分子质量的计算方法,混合物分离方法,并能灵活运用.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目

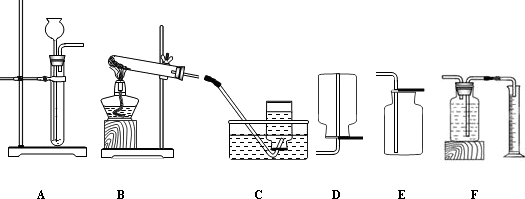

 某兴趣小组同学对实验室制备氧气的条件,及氧气的性质进行如下探究.
某兴趣小组同学对实验室制备氧气的条件,及氧气的性质进行如下探究.

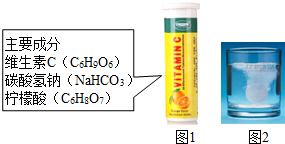 维C泡腾片(主要成分见图1)溶于水,有许多气泡产生(如图2).某兴趣小组同学对气体的成分进行如下探究.
维C泡腾片(主要成分见图1)溶于水,有许多气泡产生(如图2).某兴趣小组同学对气体的成分进行如下探究.