题目内容
【题目】配制一定溶质质量分数的氯化钠溶液常按如图操作顺序进行,请回答下列问题:

(1)计算配制100g溶质质量分数为6%的氯化钠溶液,需氯化钠质量________________________g
(2)用托盘天平称所需的氯化钠时,发现托盘天平的指针偏向左盘,接下来的操作应是________________________________。
A增加适量氯化钠固体
B减少适量氯化钠固体
C调节平衡螺母
(3)用量简来量取所需的水(水的密度为1g/cm3),量筒的规格是______________(从下列中选用:50mL、100mL 200mL) ;
(4)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是____________。
(5)如果所配得的溶液的溶质质量分数比6%小,你认为可能的原因有__________(任写一条)。
【答案】6 B 100mL 搅拌以加速氯化钠的溶解 氯化钠晶体不纯等(合理即可)
【解析】
(1)配制100g溶质质量分数为6%的氯化钠溶液,需氯化钠固体为100g×6%=6g;
(2)用托盘天平称量药品时,物体放在左盘,而砝码放在右盘,称量固体时若发现指针向左偏,说明量取的固体的质量偏大,所以应该减少适量的氯化钠固体,即选B;
(3)本题中应该量取的水的质量为100g-6g=94g,而水的密度为1g/cm3,所以需水的体积为94mL,应该选择100mL的量筒来量取;
(4)将氯化钠和水依次倒入烧杯中,用玻璃棒搅拌,其目的是搅拌以加速氯化钠的溶解;
(5)如果所配得的溶液溶质的质量分数比6%小,可能是:
氯化钠晶体不纯会导致氯化钠的质量减少,所以使溶液质量分数偏小;
用量筒取水时仰视读数会使量取的液体的体积偏大,水量多了从而造成氯化钠的质量分数偏小;
烧杯用蒸馏水润洗后再配制溶液会使得水的体积变大,水量多了从而造成氯化钠的质量分数偏小。
故答案为:(1)6;(2)A;(3)100mL;(4)搅拌以加速氯化钠的溶解;(5)氯化钠晶体不纯等。

 阅读快车系列答案
阅读快车系列答案【题目】二氧化锰在分解过氧化氢溶液反应中的催化原理为:![]() ;
;![]() 。取不同制备方法的二氧化锰与5 mL 10%过氧化氢溶液反应,测得实验数据如下表:
。取不同制备方法的二氧化锰与5 mL 10%过氧化氢溶液反应,测得实验数据如下表:
二氧化锰制备方法 | 高温分解法 | 电解法(市售) | 水热法 |
比表面积/ m2﹒g-1 | 0.468 | 49.3 | 223.274 |
催化剂的质量/mg | 3 | 3 | a |
平均催化速率/mL﹒s-1 | 0.1 | 0.4 | 0.6 |
30 s内产生氧气的体积/mL | 3 | 12 | b |
(1)根据催化原理,你对催化剂的一种新的认识是_____。
(2)根据上表数据分析:a=_____;b=_____。若使催化剂的催化速率最大,要尽可能增大_____。
【题目】(1)请结合图示实验装置,回答下列问题。
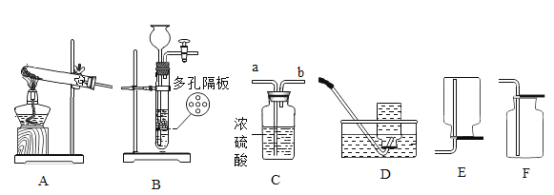
①实验室用高锰酸钾制取氧气,发生装置应选择上述装置中___________(填标号);若用过氧化氢溶液制取干燥的氧气,装置合理的连接顺序为:发生装置→C→___________(填标号);连接装置时,发生装置的出气口应与装置C中_____________(填“a”或“b”)端相连。
②实验室使用B装置制取二氧化碳的突出优点是____________;将制得的二氧化碳通入紫色石蕊试液中,观察到的现象是_____________。
(2)某化学兴趣小组用石灰石和盐酸制取一瓶CO2,验满后,将澄清石灰水倒入集气瓶中,发现没有变浑浊。兴趣小组对这个异常现象进行了探究。
(提出问题)澄清石灰水为什么没有变浑浊?
(查阅资料]①CO2过量时,CaCO3沉淀会转化为可溶于水的Ca(HCO3)2;
②AgCl不溶于稀硝酸
(提出猜想)I.石灰水已完全变质 Ⅱ_______.Ⅲ.CO2中混有HCl
(实验方案)兴趣小组用原药品继续制取CO2,并进行探究。
制备CO2的化学方程式为___________。
实验步骤 | 实验现象 | 实验结论 |
1.取少量澄清石灰水于试管中,加入________溶液。 | 产生白色沉淀 | 猜想I不成立 |
2.将少量气体通入盛有澄清石灰水的试管中 | __________ | 猜想Ⅱ不成立 |
3.____________ | ______________ | 猜想Ⅲ成立 |









