题目内容
12.生活中“衣食住行”各个方面都离不开化学,请回答下列问题:(1)小明查看校服标签,发现其主要成分为涤纶,请写出涤纶的优点和缺点;优点:耐磨、耐腐蚀;缺点:吸水透气性差
(2)小明在自己家厨房中发现了加碘食盐,在食盐中加碘的作用是防止得甲状腺疾病
(3)小明家以前用液化石油气(主要成分C3H8、C4H10),现在改为天然气,大大方便了生活,他家的燃气泄漏报警器位置应如何改动由燃气灶的下方改到燃气灶的上方;
(4)汽车的普及方便我们出行,但是随之而来的污染也很严重,为了减少污染,小明应向汽车制造厂家提出的合理化建议是在排气管道口处加催化净化装置.
分析 (1)根据合成纤维的优缺点来分析;
(2)根据碘的生理功能来分析;
(3)根据物质的性质来分析;
(4)减少汽车尾气的污染可通过改进发动机的燃烧方式,使汽油能充分燃烧;使用催化剂净化装置,使有害气体转化为无害物质;使用无铅汽油,禁止含铅物质排放等分析解答.
解答 解:(1)涤纶的优点:耐磨、耐腐蚀;缺点:吸水透气性差;故填:优点:耐磨、耐腐蚀;缺点:吸水透气性差;
(2)在食盐中加入适量的碘,可防止得甲状腺疾病;故填:防止得甲状腺疾病;
(3)甲烷的密度比空气小,燃气泄漏报警器的位置要高一些,故填:由燃气灶的下方改到燃气灶的上方;
(4)减少汽车尾气的方法有:改进发动机的燃烧方式,使汽油能充分燃烧;使用催化剂净化装置,使有害气体转化为无害物质;
故填:在排气管道口处加催化净化装置(合理即可).
点评 环境保护问题是人们关注的热点,也是化学考查的热点,了解减少汽车尾气的污染的措施即可正确解答本题.

练习册系列答案
相关题目
4.某同学梳理并归纳了以下知识点:①用肥皂水能区分硬水和软水;②在化学反应中只有燃烧才能放出热量;③农业上可以用二氧化碳做气体肥料;④最外层电子数为8的粒子一定是稀有气体的原子;⑤无论是吸入的空气还是呼出的气体中含量最多的气体都是氧气;⑥爱护水资源的有效途径是防止水体污染等.其中正确的是( )
| A. | ①②④ | B. | ①③④ | C. | ①③⑥ | D. | ②⑤⑥ |
1.蛇纹石矿可以看做MgO、Fe2O3、Al2O3、SiO2组成.由蛇纹石制取碱式碳酸镁的实验步骤如图所示:
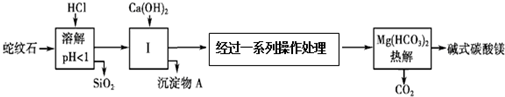
查阅资料:1.几种物质沉淀和溶解时的pH如下表
2.难溶性碱加热会生成两种氧化物,各元素化合价都不变.
探究一:制取碱式碳酸镁
(1)在操作Ⅰ中发生的中和反应是Ca(OH)2+2HCl=CaCl2+2H2O(用化学方程式表示).
(2)进行操作Ⅰ时,需控制溶液pH=6~7,Ca(OH)2不能过量.若Ca(OH)2过量,可能导致Al(OH)3溶解、Mg(OH)2沉淀.
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入NaOH(填入
物质的化学式),然后过滤、洗涤、灼烧(依次填写实验操作名称).
探究二:确定产品碱式碳酸镁(m MgCO3•n Mg(OH)2•x H2O)的组成,组装如图1仪器: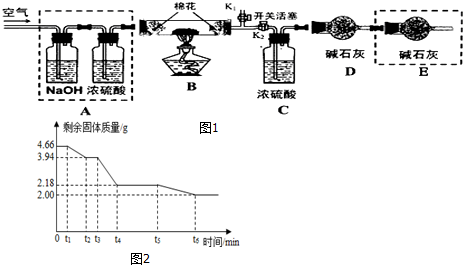
实验测得:硬质玻璃管中剩余的固体质量为2.0g,C处浓H2SO4增重0.9g,D处碱石灰增重1.76g.
(1)仪器连接后,需要进行的操作是检验装置气密性;
(2)A框中装置的作用是除去鼓入空气中的二氧化碳和水蒸气;
(3)通过计算写出碱式碳酸镁的化学式.(请写出计算过程)4MgCO3•Mg(OH)2•4H2O
【交流与反思】
(1)若将E框中的装置去掉,对实验结果的影响是m值偏大,x值偏大(填“偏大”、“偏小”或“不变”)
(2)已知碳酸镁和氢氧化镁在不同的温度下受热易分解为氧化物.为精确测定此碱式碳酸镁受热分解过程中时间与剩余固体质量的关系,结合以上数据,作出图2坐标系,试回答.
①t4~t5时间段固体的化学式为Mg(OH)2和MgO;
②t5~t6时间段发生反应的方程式为Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O.

查阅资料:1.几种物质沉淀和溶解时的pH如下表
| 氢氧化物 | 溶液pH | |||
| 开始沉淀 | 沉淀完全 | 沉淀开始溶解 | 沉淀完全溶解 | |
| Fe(OH)3 | 2.3 | 3.4 | 沉淀不溶 | 沉淀不溶 |
| Al(OH)3 | 3.3 | 5.2 | 7.8 | 12.8 |
| Mg(OH)2 | 8.6 | 11.1 | 沉淀不溶 | 沉淀不溶 |
探究一:制取碱式碳酸镁
(1)在操作Ⅰ中发生的中和反应是Ca(OH)2+2HCl=CaCl2+2H2O(用化学方程式表示).
(2)进行操作Ⅰ时,需控制溶液pH=6~7,Ca(OH)2不能过量.若Ca(OH)2过量,可能导致Al(OH)3溶解、Mg(OH)2沉淀.
(3)从沉淀混合物A中提取红色氧化物作颜料,先向沉淀物A中加入NaOH(填入
物质的化学式),然后过滤、洗涤、灼烧(依次填写实验操作名称).
探究二:确定产品碱式碳酸镁(m MgCO3•n Mg(OH)2•x H2O)的组成,组装如图1仪器:

实验测得:硬质玻璃管中剩余的固体质量为2.0g,C处浓H2SO4增重0.9g,D处碱石灰增重1.76g.
(1)仪器连接后,需要进行的操作是检验装置气密性;
(2)A框中装置的作用是除去鼓入空气中的二氧化碳和水蒸气;
(3)通过计算写出碱式碳酸镁的化学式.(请写出计算过程)4MgCO3•Mg(OH)2•4H2O
【交流与反思】
(1)若将E框中的装置去掉,对实验结果的影响是m值偏大,x值偏大(填“偏大”、“偏小”或“不变”)
(2)已知碳酸镁和氢氧化镁在不同的温度下受热易分解为氧化物.为精确测定此碱式碳酸镁受热分解过程中时间与剩余固体质量的关系,结合以上数据,作出图2坐标系,试回答.
①t4~t5时间段固体的化学式为Mg(OH)2和MgO;
②t5~t6时间段发生反应的方程式为Mg(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$MgO+H2O.
 水是最普通、最常见的物质之一.
水是最普通、最常见的物质之一.
