题目内容
有氮气、一氧化碳和二氧化碳的混合气体40g,其中碳元素的质量分数为30%。使该混合气体通过足量的灼热氧化铁充分反应后。再将气体通入过量的石灰水中,能得到白色沉淀的质量为( )
| A.30g | B.50g | C.100g | D.150g |
C
解析试题分析:根据质量守恒定律,氧化铁不含碳元素,氮气、CO、CO2中碳元素的质量在与氧化铁反应前后保持不变,即与氧化铁反应后,所得二氧化碳中碳元素质量仍为40g×30%=12g。将这些二氧化碳全部通入石灰水,由于石灰水为氢氧化钙,也不含碳元素,所以得到碳酸钙中碳元素的质量仍为12g,根据碳酸钙的化学式,碳酸钙中碳元素质量分数为12%,则碳酸钙的质量为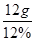 =100g。
=100g。
考点:质量守恒定律应用

练习册系列答案
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案
相关题目
如图所示装置可用于探究一氧化碳的性质。下列对该实验的分析错误的是( )
| A.实验前,应先点燃装置③的酒精灯,再通一氧化碳,以免污染空气 |
| B.实验中可观察到装置①的玻璃管内黑色固体变成光亮红色 |
| C.装置②可验证二氧化碳,还可以吸收一定量二氧化碳 |
| D.实验结束时,先熄灭装置①的酒精灯,继续通一氧化碳至玻璃管冷却 |
如果要除去二氧化碳中混有的少量一氧化碳,应该采用的方法是( )
| A.把混合气体点燃 |
| B.将混合气体通过澄清的石灰水 |
| C.将混合气体通过灼热的氧化铜 |
| D.把混合气体从一个容器倒到另一个容器中 |



