题目内容
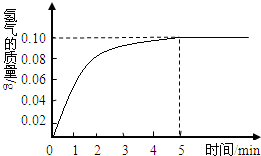
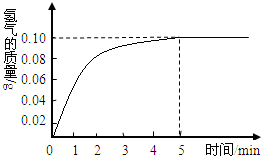
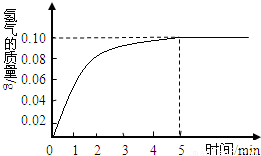
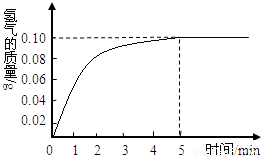
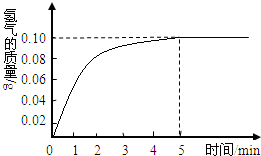
一块质量为8克的铜锌合金与96.85克的稀盐酸恰好完后反应,反应产生的氢气和反应时间关系如图所示.求:
(1)原合金中含铜多少克;
(2)反应后所得溶液溶质质量分数为多少.

(1)原合金中含铜多少克;
(2)反应后所得溶液溶质质量分数为多少.
根据产生的氢气和反应时间关系图所示,恰好完全反应时放出氢气0.10g
设参加反应锌的质量为x,反应同时生成氯化锌的质量为y
Zn+2HCl=ZnCl2+H2↑
65 136 2
x y 0.10g
=
x=3.25g
=
y=6.8g
原合金中含铜的质量=8g-3.25g=4.75g
反应后所得溶液溶质质量分数=
×100%=6.8%
答:(1)原合金中含铜4.75克;
(2)反应后所得溶液溶质质量分数为6.8%.
设参加反应锌的质量为x,反应同时生成氯化锌的质量为y
Zn+2HCl=ZnCl2+H2↑
65 136 2
x y 0.10g
| 65 |
| x |
| 2 |
| 0.10g |
| 136 |
| y |
| 2 |
| 0.10g |
原合金中含铜的质量=8g-3.25g=4.75g
反应后所得溶液溶质质量分数=
| 6.8g |
| 3.25g+96.85g-0.10g |
答:(1)原合金中含铜4.75克;
(2)反应后所得溶液溶质质量分数为6.8%.

练习册系列答案
 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目