题目内容
19.要测定MgCl2(杂质是NaCl)的质量分数,取样品10g溶于100g水中,向其中加入50g NaOH溶于至恰好完全反应,得到沉淀5.8g.已知:MgCl2+2NaOH═Mg(OH)2↓+2NaCl,求:(1)样品中MgCl2的质量分数.
(2)所用NaOH溶液的溶质质量分数.
分析 (1)由氢氧化镁沉淀的质量计算样品中氯化镁的质量,进一步计算样品中MgCl2的质量分数;
(2)由氢氧化镁沉淀的质量计算样品中氢氧化钠的质量,进一步计算所用NaOH溶液的溶质质量分数.
解答 解:(1)设生成5.8g氢氧化镁沉淀时,消耗氯化镁的质量为x,氢氧化钠的质量为y
MgCl2+2NaOH═Mg(OH)2↓+2NaCl
95 80 58
x y 5.8g
$\frac{95}{x}$=$\frac{80}{y}$=$\frac{58}{5.8g}$
x=9.5g,y=8g
样品中MgCl2的质量分数为$\frac{9.5g}{10g}$×100%=95%,
(2)所用NaOH溶液的溶质质量分数为$\frac{8g}{50g}$×100%=16%
答:(1)样品中MgCl2的质量分数为95%;(2)所用NaOH溶液的溶质质量分数为16%.
点评 根据反应的化学方程式可以表示反应中各物质的质量比,由反应中任意物质的质量可计算反应中其它物质的质量.

练习册系列答案
相关题目
7.甲、乙两个化工厂的废水中共含有各不相同的七种离子:Ag+、K+、Cu2+、Fe3+、Cl-、OH-、NO3-,测知甲厂的废水pH=13,则甲厂废水中含有的离子是( )
| A. | K+、Cl-、NO3-、OH- | B. | K+、NO3-、OH- | C. | K+、Cl-、OH- | D. | K+、OH- |
4.下列实验操作规范的是( )
| A. |  蒸发 | B. |  液体加热 | C. |  加入固体药品 | D. |  熄灭酒精灯 |
11.在点燃条件下,A和B反应生成C和D,反应前后分子变化的微观示意图如图所示.下列说法错误的是( )


| A. | 该反应为置换反应 | |
| B. | 反应前后各元素的质量不变 | |
| C. | 反应中生成C和D的质量比为14:27 | |
| D. | 该反应中A与B的化学计量数之比为3:4 |
8.下列操作正确的是( )
| A. |  过滤 | B. |  洗涤试管 | ||
| C. |  点燃酒精灯 | D. |  读液体的体积 |

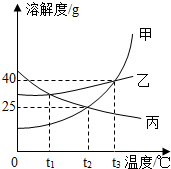 如图为甲、乙、丙三种固体物质的溶解度曲线,请回答.
如图为甲、乙、丙三种固体物质的溶解度曲线,请回答.