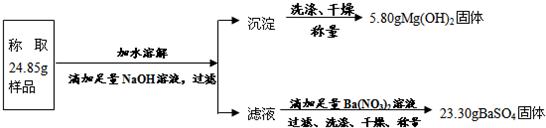
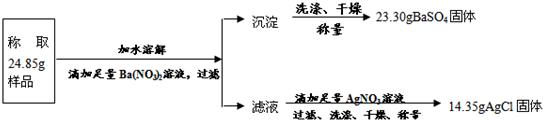
题目内容
 16、14、某化学活动小组对过量炭粉与氧化铁反应中气体的成分进行研究.
16、14、某化学活动小组对过量炭粉与氧化铁反应中气体的成分进行研究.(1)假设:该反应的气体产物全部是二氧化碳.
(2)设计方案:将一定量的氧化铁在隔绝氧气的条件下与过量炭粉完全反应,测定参加反应的碳元素与氧元素的质量比
(3)查阅资料:氮气不与碳、氧化铁反应,可用来隔绝氧气
(4)实验:

(5)数据处理:经计算,参加反应的碳元素质量为0.48g,氧元素质量为0.96g…
(6)结论:根据数据处理结果,得出原假设不成立,理由是
在本实验中碳氧两元素的质量比为0.48g:0.96g=1:2而在二氧化碳中碳氧元素的质量比为3:8,故不是纯的二氧化碳气体.
.分析:本题属于实验探究题,单质碳的化学性质有两个:可燃性和还原性,本题考查了单质碳的还原性.碳做还原剂时装置中要隔绝空气,避免碳发生燃烧,因此用氮气把整个装置内的空气排出去.装置中各个仪器的名称要记牢,检验二氧化碳时要用澄清的石灰水.根据数据处理,参加反应的碳元素质量为0.48g,氧元素质量为0.96g,本实验中碳氧两元素的质量比为0.48g:0.96g=1:2,原假设不成立.
解答:解:(4)仪器的名称是基本的实验常识,本题的仪器是铁架台和试管,通入氮气的目的是:排尽装置中的空气,避免氧气产生干扰.试管中的石灰水是用来检验二氧化碳的.
故答案为:
(6)在数据处理中,题目告诉我们的信息是:经计算,参加反应的碳元素质量为0.48g,氧元素质量为0.96g,两元素的质量比为0.48g:0.96g=1:2,而在二氧化碳中碳氧元素的质量比为3:8,故不是纯的二氧化碳气体.
故答案为:在本实验中碳氧两元素的质量比为0.48g:0.96g=1:2,而在二氧化碳中碳氧元素的质量比为3:8,故不是纯的二氧化碳气体.
故答案为:
| 操作步骤及实验现象 | 简答 |
| 仪器的名称:A 铁架台;B 试管; | |
| 其目的是:排尽装置中的空气,避免氧气产生干扰. | |
| 该现象说明:木炭和氧化铁反应有二氧化碳气体生成. | |
故答案为:在本实验中碳氧两元素的质量比为0.48g:0.96g=1:2,而在二氧化碳中碳氧元素的质量比为3:8,故不是纯的二氧化碳气体.
点评:本考点属于实验探究题,既有实验方法和过程的探究,又有实验数据的分析和结论的探究,综合性比较强.要记住单质碳的可燃性和还原性,希望同学们认真分析,综合掌握.本考点主要出现在实验题中.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某化学活动小组用稀盐酸对赤铁矿中Fe2O3含量进行测定(杂质不与盐酸反应且不溶于水),得到一黄色残液.为防止直接排放造成环境污染,对其进行了处理,过滤该残液,取100g 滤液,向其中不断加入某未知溶质质量分数的氢氧化钠溶液,所得
实验数据如下表:
(资料:FeCl3+3NaOH=Fe(OH)3↓+3NaCl)
通过对上述实验数据的分析,选择合理的数据,计算所加氢氧化钠溶液中溶质的质量分数.
实验数据如下表:
| 加入氢氧化钠溶液的总质量/g | 20 | 40 | 60 | 80 | 140 | 160 |
| 生成沉淀的质量/g | 0 | 0 | 1.07 | 2.14 | 5.35 | 5.35 |
通过对上述实验数据的分析,选择合理的数据,计算所加氢氧化钠溶液中溶质的质量分数.
(3分)某化学活动小组用稀盐酸对赤铁矿中Fe2O3含量进行测定(杂质不与盐酸反应且不溶于水),得到一黄色残液。为防止直接排放造成环境污染,对其进行了处理,过滤该残液,取100 g 滤液,向其中不断加入某未知溶质质量分数的氢氧化钠溶液,所得
实验数据如下表:
|
加入氢氧化钠溶液的总质量/g |
20 |
40 |
60 |
80 |
140 |
160 |
|
生成沉淀的质量/g |
0 |
0 |
1.07 |
2.14 |
5.35 |
5.35 |
(资料:FeCl3 + 3NaOH = Fe(OH)3↓+ 3NaCl)
通过对上述实验数据的分析,选择合理的数据,计算所加氢氧化钠溶液中溶质的质量
分数。