题目内容
6、下列几种说法中,正确的是( )
分析:根据溶液的定义和溶液的特点来做本题.
解答:解:溶液是指一种物质或几种物质分散到另一种物质中,形成均一稳定的混合物.具有三个特点:均一、稳定、混合物;
A中凡是均一、稳定的混合物,才是是溶液,所以是错误的;
C中长期放置,不会分层的液体,不一定是溶液,例如蒸馏水属于纯净物,不是溶液;
D中一种物质分散到另一种物质而形成的液体必须是均一稳定才行,否则有可能是悬浊液或乳浊液.
故选B.
A中凡是均一、稳定的混合物,才是是溶液,所以是错误的;
C中长期放置,不会分层的液体,不一定是溶液,例如蒸馏水属于纯净物,不是溶液;
D中一种物质分散到另一种物质而形成的液体必须是均一稳定才行,否则有可能是悬浊液或乳浊液.
故选B.
点评:只有符合均一、稳定、混合物这三个要点的液体才属于溶液.

练习册系列答案
相关题目
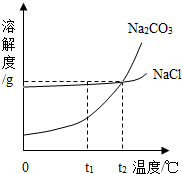 我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:
我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:(1)①t1℃时,NaCl的溶解度
②“冬天捞碱”的原因是由于Na2CO3的溶解度随温度降低而
③“夏天晒盐”是利用
A.利用风吹日晒,使溶剂蒸发 B.升高温度,使NaCl溶解度增大
(2)根据下表分析:
| 温度 物质 |
0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2CO3 | 7.0 | 12.5 | 21.5 | 39.0 | 49.0 |
②下列几种说法中,正确的是
A.碳酸钠晶体的溶解度受温度影响较大
B.将含水各1OOg的氯化钠与碳酸钠的饱和溶液,从30℃降至O℃,析出晶体的质量相等 C.t2对应的温度在2O℃-30℃之间
D.欲从含有少量NaCl杂质的碳酸钠浓溶液中分离出碳酸钠晶体,应采取降低溶液温度的方式.
 我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:
我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:
(1)①t1℃时,NaCl的溶解度______ Na2CO3的溶解度.(用“>”“<”或“=”表达)
②“冬天捞碱”的原因是由于Na2CO3的溶解度随温度降低而______(填“增大”“减小”或“不变”).“捞碱”后剩余的溶液一定是Na2CO3的______(填“饱和”或“不饱和”)溶液.
③“夏天晒盐”是利用______(填序号)的方法,使NaCl晶体析出.
A.利用风吹日晒,使溶剂蒸发 B.升高温度,使NaCl溶解度增大
(2)根据下表分析:
| 温度 物质 | 0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2CO3 | 7.0 | 12.5 | 21.5 | 39.0 | 49.0 |
②下列几种说法中,正确的是______.
A.碳酸钠晶体的溶解度受温度影响较大
B.将含水各1OOg的氯化钠与碳酸钠的饱和溶液,从30℃降至O℃,析出晶体的质量相等 C.t2对应的温度在2O℃-30℃之间
D.欲从含有少量NaCl杂质的碳酸钠浓溶液中分离出碳酸钠晶体,应采取降低溶液温度的方式.
 如图是a、b、c三种物质的溶解度曲线.由图判断下列几种说法中不正确的是( )
如图是a、b、c三种物质的溶解度曲线.由图判断下列几种说法中不正确的是( )