题目内容
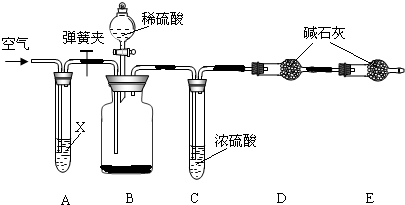
下图所示装置可用于测定空气中氧气的含量,实验前在集气瓶内加入少量水,并做上记号。下列选项中,正确的是

A.红磷燃烧反应:2P + O2 === P2O5
B.红磷熄灭后立刻打开弹簧夹
C.最终进入瓶中水的体积约为氧气的体积
D.实验时可在燃烧匙中燃烧木炭,代替红磷
【答案】
C
【解析】A、红磷燃烧生成五氧化二磷,反应的化学方程式是4P+5O2=2P2O5,故A错误
B、红磷熄灭后不应立刻打开弹簧夹,应等装置冷却后,打开弹簧夹,否则会造成测量结果偏小,故B错误
C、因为集气瓶中氧气全部被消耗掉,所以进入的水的体积约是氧气的体积,故C正确
D、因为木炭与氧气反应生成物为气体,不能用于该实验,故D错误
故选C

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案
相关题目
碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
查阅资料:获得的资料有:
(1)补钙剂中常加入糖类、维生素D等改善口感或增强药效.这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解.
(2)碳酸钙高温灼烧分解生成氧化钙和二氧化碳.
(3)常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量.
 (4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15g Ca(OH)2.
(4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15g Ca(OH)2.
方案设计和实施:根据资料和已学知识,该小组同学设计如下两种方案进行测定.
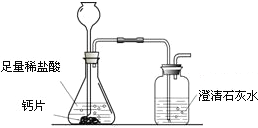
方案1:根据下图所示装置实验.
(1)锥形瓶中发生反应的化学方程式为 .
(2)长颈漏斗下部插入液面下的目的是 .
(3)加入药品前,检验该装置气密性的方法是 .
(4)记录数据如下:
方案2:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量.记录数据如下(空烧杯质量为100g,加入钙片质量为25g):
分析和评价:
(1)方案1和方案2中合理的是 ,原因是 .
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是 .
(3)要使用查阅资料(3)中介绍的方法,还需要学习的是 .
结论:经过计算,该钙片中碳酸钙的质量分数是 .
查阅资料:获得的资料有:
(1)补钙剂中常加入糖类、维生素D等改善口感或增强药效.这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解.
(2)碳酸钙高温灼烧分解生成氧化钙和二氧化碳.
(3)常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量.
 (4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15g Ca(OH)2.
(4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15g Ca(OH)2.方案设计和实施:根据资料和已学知识,该小组同学设计如下两种方案进行测定.
方案1:根据下图所示装置实验.
(1)锥形瓶中发生反应的化学方程式为
(2)长颈漏斗下部插入液面下的目的是
(3)加入药品前,检验该装置气密性的方法是
(4)记录数据如下:
| 钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
| 25g | 100g | 200g | 300.4g |
| 加入稀盐酸的质量 | 100g | 200g | 300g | 400g |
| 充分反应后烧杯及杯内物质总质量 | 222.8g | 320.6g | 418.4g | 518.4g |
(1)方案1和方案2中合理的是
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(实验室可以进行该实验),原因是
(3)要使用查阅资料(3)中介绍的方法,还需要学习的是
结论:经过计算,该钙片中碳酸钙的质量分数是