题目内容
把20g铁和铜的混合物放入盛有足量稀硫酸的烧杯中,充分反应后,烧杯中剩余物的总质量比反应前各物质的总质量减少0.4g.求原混合物中铜的质量分数.
答案:
解析:
解析:
|
44% |

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知某混合金属粉末中除铝外还含有铁、铜中的一种或两种,所含金属的量 都在5%以上.请设计实验探究该粉末中铁、铜的存在.
都在5%以上.请设计实验探究该粉末中铁、铜的存在.
资料在线:
铝与氢氧化钠溶液反应生成溶于水的偏铝酸钠和氢气(2Al+2H2O+2NaOH=2NaAlO2+3H2↑),铁和铜不与氢氧化钠溶液反应.
可供选择的实验用品:烧杯、大试管、量筒、滴管、燃烧匙、药匙、磁铁;稀硫酸、稀盐酸、Na0H溶液、氨水.
请你参与并完成以下实验探究过程:
I、提出假设
(1)假设1:该混合金属粉末中除铝外还含有Fe.
(2)假设2:该混合金属粉末中除铝外还含有______.
(3)假设3:该混合金属粉末中除铝外还含有Fe、Cu.
II、设计并实施实验方案
(4)基于假设1,不用化学试剂,证明金属铁的存在可用______.
(5)基于假设2,将混合金属粉末加入足量稀盐酸,你观察到的现象是______.
(6)基于假设3,请你完成实验操作,描述实验现象.
| 实验步骤 | 实验操作(说明仪器和试剂) | 实验现象 | 结论 |
| ① | 取少许粉末放入大试管中,再滴加______,充分反应后,静置,弃去清液得到固体. | 固体粉末______, 有______. | 仅除去铝 |
| ② | 再往大试管中加______,充分反应. | 固体______, 溶液______. | 证明含有铁 |
| ③ | 将大试管静置,弃去上层清液,加水,多次洗涤剩余固体 | 剩余固体呈紫红色 | 证明含有铜 |
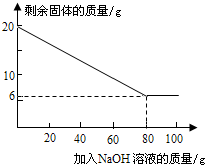
(7)为测定混合金属粉末中铝的质量分数,取20g该金属粉末,把100g氢氧化钠溶液平均分成5份依次加入,充分反应后,过滤出固体,将其洗涤、干燥、称量.实验过程中得到的部分数据与图象如下:
| 加NaOH溶液的次数 | 第一次 | 第二次 | 第三次 | … |
| 剩余固体的质量/g | 1 6.5 | n | 9.5 | … |
②该金属粉末中Al的质量分数为______%;
③列式计算:所用氢氧化钠溶液的溶质质量分数为多少?
 都在5%以上.请设计实验探究该粉末中铁、铜的存在.
都在5%以上.请设计实验探究该粉末中铁、铜的存在.