题目内容
11.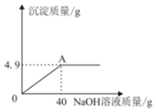 向160g硫酸铜溶液中,逐滴加入50gNaOH溶液,完全反应,生成4.9g沉淀,回答下列有关问题:(相对原子质量:Cu-64)
向160g硫酸铜溶液中,逐滴加入50gNaOH溶液,完全反应,生成4.9g沉淀,回答下列有关问题:(相对原子质量:Cu-64)(1)完全反应后,溶液的质量为205.1g.
(2)将反应结束后的混合物过滤,滤液中溶质是NaOH和Na2SO4(填化学式).
(3)求原硫酸铜溶液中溶质的质量分数(写出计算过程).
分析 (1)根据质量守恒定律计算完全反应后溶液的质量.
(2)根据硫酸铜与氢氧化钠的反应分析反应后的溶液中的溶质;
(3)根据生成的氢氧化铜的质量和对应的化学方程式计算硫酸铜的质量,进而求算原硫酸铜溶液中溶质的质量分数.
解答 解:(1)由质量守恒定律可知,完全反应后,溶液的质量为:160g+50g-4.9g=205.1g.
(2)由于硫酸铜溶液与氢氧化钠溶液反应生成了硫酸钠和氢氧化铜沉淀,而反应是在加入氢氧化钠溶液40g时反应完毕,所以加入50g氢氧化钠溶液时,氢氧化钠过量,所以将反应结束后的混合物过滤,滤液中溶质是:NaOH和Na2SO4;
(3)设参加反应的硫酸铜的质量为x.
CuSO4+2NaOH=Cu(OH)2↓+Na2SO4
160 98
x 4.9g
$\frac{160}{98}=\frac{x}{4.9g}$ 解得:x=8g
所以原硫酸铜溶液中溶质的质量分数为:$\frac{8g}{160g}$×100%=5%
故答为:(1)205.1;(2)NaOH和Na2SO4;(3)原硫酸铜溶液中溶质的质量分数为5%.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
1.下列有关分子、原子和离子的说法正确的是( )
| A. | 分子是保持物质性质的一种粒子 | |
| B. | 物体有热胀冷缩现象,主要是因为物体中的粒子大小随温度的改变而改变 | |
| C. | 分子、原子、离子都可以直接构成物质 | |
| D. | 在化学反应中,任何离子都不能再分 |
2.下列物质的性质与用途的对应关系错误的是( )
| 选项 | 性质 | 用途 |
| A | 氢氧化钙溶液呈碱性 | 改良酸性土壤 |
| B | 稀盐酸能与某些金属氧化物反应 | 除铁锈 |
| C | 浓硫酸具有脱水性 | 实验室干燥气体 |
| D | 氢氧化钠能与某些非金属氧化物反应 | 吸收二氧化硫 |
| A. | A | B. | B | C. | C | D. | D |
20.我们日常生活中处处有化学,下列各自的做法正确的是( )
| A. | 农村老人家常常食用变质变霉的食物 | |
| B. | 小胖用灼烧方法来鉴别合成纤维和羊毛纤维 | |
| C. | 明明认为用活性炭可以将硬水软化 | |
| D. | 一天红红家燃气灶用不起,她用打火机检查她家天然气管道是否通畅 |
1.下列与生态环保有关的说法,不正确的是( )
| A. | 改进汽车尾气净化技术 | B. | 合理开发利用可燃冰 | ||
| C. | 研发易降解的生物农药 | D. | 全面关停化工企业 |

 如图所示A~G是初中化学中常见的物质.图中“→”表示转化关系,“-”表示相互能反应.已知A时人体胃液中含有的酸,G是最轻的气体,B、C、D、E、F都是氧化物,D为红色粉末.请回答:
如图所示A~G是初中化学中常见的物质.图中“→”表示转化关系,“-”表示相互能反应.已知A时人体胃液中含有的酸,G是最轻的气体,B、C、D、E、F都是氧化物,D为红色粉末.请回答: 在含氯化钠杂质的纯碱12.6g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量关系如图所示:
在含氯化钠杂质的纯碱12.6g中逐渐加入质量分数为7.3%稀盐酸,所加稀盐酸的质量关系如图所示: A、B、C、D、E为初中化学常见的五种物质,它们之间存在如图所示的关系(“→”表示物质经一步反应可转化为另一种物质,“-”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去).请回答下列问题:
A、B、C、D、E为初中化学常见的五种物质,它们之间存在如图所示的关系(“→”表示物质经一步反应可转化为另一种物质,“-”表示相连两物质能发生化学反应,部分反应物、生成物及反应条件已略去).请回答下列问题: