题目内容
取等质量的Mg、Fe、Al、Zn分别与过量的稀H2SO4反应产生H2由多到少的顺序是( )A.Al>Mg>Zn>Fe
B.Al>Fe>Mg>Zn
C.Al>Zn>Fe>Mg
D.Al>Mg>Fe>Zn
【答案】分析:由金属活动性顺序可知反应速率快慢与金属活动性顺序有关,产生氢气的多少需根据化学方程式进行计算.
解答:解:假设金属为一能够反应且化合价为+2价的金属M,其相对原子质量为x,金属的质量为m,生成的氢气的质量为y.
M+H2SO4═MSO4+H2↑
x 2
m y
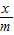 =
=
解:y=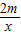
通过这个式子可以看出,当等质量的金属完全反应时,生成的氢气的质量与金属的相对原子质量成反比,相对原子质量越大,生成的氢气的质量也就越小.
铝在形成化合物时的化合价为+3,所以为了达到统一的标准可以将铝元素的化合价转化为:+3× =+2,所以其相对分子质量也可以变为:27×
=+2,所以其相对分子质量也可以变为:27× =18,所以质量相同的Al、Mg、Fe、Zn分别与足量的稀硫酸反应,产生氢气的质量依次减小.分析所给的选项可以知道选项D是正确的.
=18,所以质量相同的Al、Mg、Fe、Zn分别与足量的稀硫酸反应,产生氢气的质量依次减小.分析所给的选项可以知道选项D是正确的.
故选D.
点评:本题考查了金属与酸反应产生氢气质量的关系,完成此题,可以依据已有的知识.所以要求同学们在平时的学习中加强基础知识的记忆和理解,以便能够灵活应用.
解答:解:假设金属为一能够反应且化合价为+2价的金属M,其相对原子质量为x,金属的质量为m,生成的氢气的质量为y.
M+H2SO4═MSO4+H2↑
x 2
m y
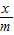 =
=
解:y=
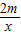
通过这个式子可以看出,当等质量的金属完全反应时,生成的氢气的质量与金属的相对原子质量成反比,相对原子质量越大,生成的氢气的质量也就越小.
铝在形成化合物时的化合价为+3,所以为了达到统一的标准可以将铝元素的化合价转化为:+3×
 =+2,所以其相对分子质量也可以变为:27×
=+2,所以其相对分子质量也可以变为:27× =18,所以质量相同的Al、Mg、Fe、Zn分别与足量的稀硫酸反应,产生氢气的质量依次减小.分析所给的选项可以知道选项D是正确的.
=18,所以质量相同的Al、Mg、Fe、Zn分别与足量的稀硫酸反应,产生氢气的质量依次减小.分析所给的选项可以知道选项D是正确的.故选D.
点评:本题考查了金属与酸反应产生氢气质量的关系,完成此题,可以依据已有的知识.所以要求同学们在平时的学习中加强基础知识的记忆和理解,以便能够灵活应用.

练习册系列答案
 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案
相关题目
 (2005?白下区一模)某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z分别与足量的溶质质量分数相等的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况如右图所示.下列对该图象理解的叙述中,正确的是( )
(2005?白下区一模)某校化学活动小组为探究X、Y、Z三种金属与酸的反应情况,进行了如下实验:取等质量的X、Y、Z分别与足量的溶质质量分数相等的稀硫酸反应,都生成+2价金属的硫酸盐,反应情况如右图所示.下列对该图象理解的叙述中,正确的是( )