题目内容
质量相等的镁、铝、铁三种金属分别与足量的盐酸反应,制取的氢气质量(y)和所用去的金属质量(x)之间的关系如下图所示,正确的是
- A.

- B.

- C.

- D.

A
分析:金属与酸发生的反应是置换反应,可设金属元素在化合物中的化合价为x,其相对原子质量为y,找出生成氢气的质量与化合价、相对原子质量的关系再判断等质量的四种金属与酸完全反应放出氢气质量的大小,从而判断关系图中四条线与金属的对应关系.
解答:质量相等的镁、铝、铁三种金属分别与足量的盐酸反应,则金属完全参加反应
设金属元素在化合物中的化合价为x,其相对原子质量为y,该金属为M,金属的质量为1g,生成氢气的质量为N,则有
2M+2xHCl═2MClx+xH2↑
2y 2x
1g N
 =
=
N=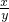 g
g
则1g的Mg、Fe、Al生成氢气的质量分别为 g、
g、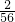 g、
g、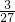 g,由此可知等质量 的三种金属生成氢气的质量由多到少的顺序是铝、镁、铁;
g,由此可知等质量 的三种金属生成氢气的质量由多到少的顺序是铝、镁、铁;
故选A.
点评:通过题目分析可知等质量的金属与酸完全反应放出氢气的质量等于它们的‘价量比’,即化合价与相对原子质量之比,可代入应用,这是解答的关键.
分析:金属与酸发生的反应是置换反应,可设金属元素在化合物中的化合价为x,其相对原子质量为y,找出生成氢气的质量与化合价、相对原子质量的关系再判断等质量的四种金属与酸完全反应放出氢气质量的大小,从而判断关系图中四条线与金属的对应关系.
解答:质量相等的镁、铝、铁三种金属分别与足量的盐酸反应,则金属完全参加反应
设金属元素在化合物中的化合价为x,其相对原子质量为y,该金属为M,金属的质量为1g,生成氢气的质量为N,则有
2M+2xHCl═2MClx+xH2↑
2y 2x
1g N
 =
=
N=
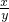 g
g则1g的Mg、Fe、Al生成氢气的质量分别为
 g、
g、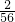 g、
g、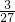 g,由此可知等质量 的三种金属生成氢气的质量由多到少的顺序是铝、镁、铁;
g,由此可知等质量 的三种金属生成氢气的质量由多到少的顺序是铝、镁、铁;故选A.
点评:通过题目分析可知等质量的金属与酸完全反应放出氢气的质量等于它们的‘价量比’,即化合价与相对原子质量之比,可代入应用,这是解答的关键.

练习册系列答案
相关题目







