题目内容
实验课上,为检验镁条能否在N2中燃烧,兴趣小组展开如下探究:
【查阅资料】氮化镁(Mg3N2)是一种淡黄色固体,能和水反应,生成Mg(OH)2和NH3;
【实验步骤】
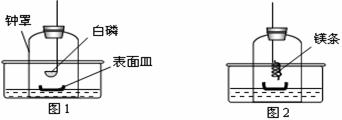
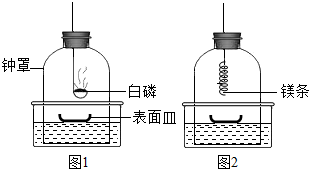
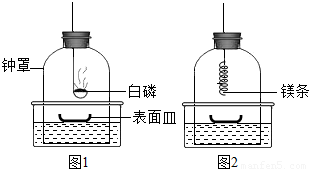
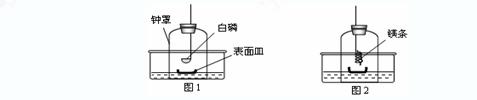
①将足量白磷在空气中点燃后,迅速伸入钟罩内,塞紧橡皮塞(图1);
②待钟罩内水面不再变化时,向水槽中加水,使水槽中液面与钟罩内液面相平;
③打开橡皮塞,将燃着的螺旋状镁条迅速伸入钟罩内,塞紧橡皮塞(图2);
④待钟罩内水面不再变化时,观察钟罩内壁及表面皿中固体颜色,取少量固体加入水中。
【分析】
(1)步骤①中足量白磷在钟罩内燃烧的目的是 ▲ ;
(2)步骤②中加水的目的是 ▲ ;
(3)步骤③中镁条绕城螺旋状的目的是 ▲ ;镁条剧烈燃烧,反应的化学方程式
为 ▲ ;
(4)步骤④中钟罩内壁及表面皿中出现淡黄色固体。加入水中,产生白色浑浊及能使湿润红色石蕊试纸变 ▲ 色的气体,反应的化学方程式为 ▲ ;
【结论】
镁能在N2中燃烧,并生成Mg3N2。
(5)请你判断:2.40g镁条在某密闭容器中完全燃烧,所得固体质量可能为 ▲ ;
[相对分子质量 —— Mr(MgO)∶40、 Mr(Mg3N2)∶100]
A.3.33g B.4.00g C.3.93g D.3.96g
(1)除去钟罩内空气中的氧气,以便镁条在氮气中燃烧
|
(3)增大接触面积、积聚热量 3Mg + N2 ==== Mg3N2
(4)蓝 Mg3N2 + 6H2O == 3Mg(OH)2 + 2NH3↑
(5)(2分)CD

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目
 的是 ;
的是 ;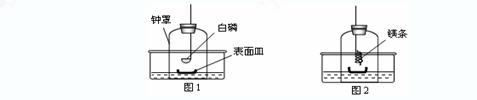
 的是 ;
的是 ;