题目内容
6.写出指定元素的化合价SO2 中S为+4价;SO3 中S为+6价;C2H4中C为-2价;CH4中C为-4价;
O3中O为0价;O2中O为0价;HNO3中N为+5价;NaNO2中N为+3价;
H3PO4中P为+5价;P2O3 中P为+3价; KClO3中Cl为+5价;
KIO3中I为+5价;FeO中Fe为+2价;Fe2O3中Fe为+3价.
分析 单质中元素的化合价为0、在化合物中正负化合价代数和为零,结合物质的化学式进行解答本题.
解答 解:氧元素显-2价,设硫元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:x+(-2)×2=0,则x=+4价.
氧元素显-2价,设硫元素的化合价是y,根据在化合物中正负化合价代数和为零,可得:y+(-2)×3=0,则y=+6价.
氢元素显+1价,设碳元素的化合价是z,根据在化合物中正负化合价代数和为零,可得:2z+(+1)×4=0,则z=-2价.
氢元素显+1价,设碳元素的化合价是m,根据在化合物中正负化合价代数和为零,可得:m+(+1)×4=0,则m=-4价.
根据单质中元素的化合价为0,O3属于单质,故氧元素的化合价为0.
根据单质中元素的化合价为0,O2属于单质,故氧元素的化合价为0.
同理可以计算出HNO3中N为+5价;NaNO2中N为+3价;H3PO4中P为+5价;P2O3 中P为+3价;KClO3中Cl为+5价;KIO3中I为+5价;FeO中Fe为+2价;Fe2O3中Fe为+3.
故填:+4;+6;-2;-4;0;0;+5;+3;+5;+3;+5;+5;+2;+3.
点评 本题难度不大,掌握利用化合价的原则计算指定元素的化合价的方法即可正确解答本题.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19.世界上每年因锈蚀而报废的金属设备和材料,高达产量的20%~40%,某实验小组对铁的燃烧和锈蚀进行如下探究.
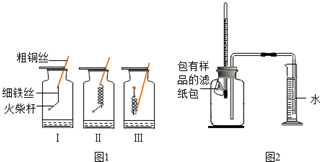
探究一:铁丝燃烧
如图1所示,取3根粗细、长度均相同的光亮细铁丝,将其中两根分别盘成螺旋状,在每根铁丝一端系上粗铜丝,另一端系一根火柴杆,点燃火柴杆待快燃尽时,分别插入充满氧气的集气瓶中,观察到:观察到:Ⅰ、Ⅱ中铁丝都剧烈燃烧,且Ⅱ中铁丝燃烧比I中的更剧烈;Ⅲ中铁丝没有燃烧.
(1)集气瓶中加入少量水的作用:防止铁燃烧时形成的高温熔融物溅落炸裂集气瓶.
(2)为什么Ⅲ中铁丝不能燃烧温度没有达到铁的着火点.
(3)分析Ⅱ中铁丝燃烧比Ⅰ中更剧烈的原因Ⅱ中铁丝与氧气的接触面积比Ⅰ中铁丝与氧气的接触面积大.
探究二:铁粉腐蚀的条件
如图2所示,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,观察到量筒内水沿着细导管慢慢进广口瓶(容积为146mL).当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零).记录起始和最终量筒的读数以及所需时间如下表.
(4)金属腐蚀的过程实际上就是金属元素化合价升高(填“升高”或“降低”)的过程.
(5)实验①和②说明NaCl可以加快 (填“加快”或“减慢”)铁锈蚀的速率.
(6)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是放热(填“放热”或“吸热”)过程.
(7)实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成是1g铁粉和10滴水.
(8)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是19.2%%(精确到小数点后1位),试分析该实验结果出现误差的原因样品不足(写任意一条即可)

探究一:铁丝燃烧
如图1所示,取3根粗细、长度均相同的光亮细铁丝,将其中两根分别盘成螺旋状,在每根铁丝一端系上粗铜丝,另一端系一根火柴杆,点燃火柴杆待快燃尽时,分别插入充满氧气的集气瓶中,观察到:观察到:Ⅰ、Ⅱ中铁丝都剧烈燃烧,且Ⅱ中铁丝燃烧比I中的更剧烈;Ⅲ中铁丝没有燃烧.
(1)集气瓶中加入少量水的作用:防止铁燃烧时形成的高温熔融物溅落炸裂集气瓶.
(2)为什么Ⅲ中铁丝不能燃烧温度没有达到铁的着火点.
(3)分析Ⅱ中铁丝燃烧比Ⅰ中更剧烈的原因Ⅱ中铁丝与氧气的接触面积比Ⅰ中铁丝与氧气的接触面积大.
探究二:铁粉腐蚀的条件
如图2所示,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,观察到量筒内水沿着细导管慢慢进广口瓶(容积为146mL).当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零).记录起始和最终量筒的读数以及所需时间如下表.
| 序号 | 样品 | 量筒起始 读数/mL | 量筒最终 读数/mL | 所需时间 /min |
| 1 | 1g铁粉、0.2g碳和10滴水 | 100 | 72 | 约120 |
| 2 | lg铁粉、0.2g碳、10滴水和少量NaCl | 100 | 72 | 约70 |
| 3 | 1g铁粉和10滴水 | \ | \ | \ |
(5)实验①和②说明NaCl可以加快 (填“加快”或“减慢”)铁锈蚀的速率.
(6)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是放热(填“放热”或“吸热”)过程.
(7)实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成是1g铁粉和10滴水.
(8)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是19.2%%(精确到小数点后1位),试分析该实验结果出现误差的原因样品不足(写任意一条即可)
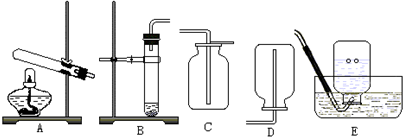
20.下列图示的实验操作不正确的是( )
| A. |  点燃酒精灯 | B. |  检查装置的气密性 | ||
| C. |  倾倒液体 | D. |  加热液体 |
17.在化学反应A+B=C+D中,若20g A物质和10g B物质恰好全反应,生成5g C物质.则5g A物质与5g B物质反应,可生D物质的量是( )
| A. | 17.5g | B. | 15g | C. | 12.5g | D. | 6.25g |
1.成语被誉为中华民族的瑰宝.下列成语中,其本意主要为化学变化的是( )
| A. | 磨杵成针 | B. | 死灰复燃 | C. | 木已成舟 | D. | 积土成山 |
11.向ZnCl2、CuCl2溶液加入一定量铁粉,充分反应后过滤,向滤液中加入硝酸银溶液有白色沉淀,向滤渣中加入硝酸银有银白色固体出现,则下列有关滤液、滤渣成分说法不正确的是( )
| A. | 滤渣中一定有铜 | B. | 滤液中一定有ZnCl2和FeCl2 | ||
| C. | 滤渣中一定有铜、锌 | D. | 滤液中可能含有CuCl2 |
15.实验室能直接在酒精灯火焰上加热的玻璃仪器是( )
| A. | 烧杯 | B. | 试管 | C. | 集气瓶 | D. | 量筒 |
16.下列微粒结构示意图中,能表示阴离子的是( )
| A. |  | B. |  | C. |  | D. |  |