题目内容
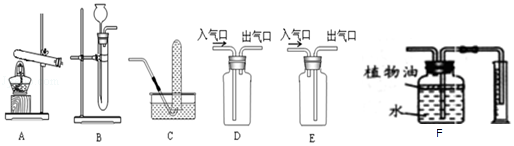
【题目】现有工厂丢弃的废铜屑(铜屑表面呈绿色).课外活动小组同学欲利用其制取硫酸铜晶体,他们设计了下面的两种制取流程(如图1).请回答: 
(1)铜屑表面呈绿色的物质化学式是Cu2(OH)2CO3 , 从组成分析,预测它除了能与稀硫酸反应后,还能与(任举一例)反应.操作①所用的玻璃仪器有烧杯、玻璃棒和;溶液A的溶质有;两种方法得到硫酸铜晶体,你觉得符合绿色化学要求的方法是 .
(2)方法二的化学反应的化学方程式为2Cu+2H2SO4+ ![]() 2CuSO4+ .
2CuSO4+ .
(3)硫酸铜晶体广泛应用在电镀、印染、农药等方面,波尔多液是一种农业常用杀菌剂,它由硫酸铜、生石灰加水配制而成,不能用铁制容器来配制波尔多液的原因是(用化学方程式表示) , 此反应属于基本反应类型中的反应.
(4)理论上废铜屑中的铜完全可以转化为硫酸铜.已知废铜屑的质量为100kg,若最后所得的硫酸铜质量为80kg,则废铜屑中铜的质量分数为 .
【答案】
(1)盐酸或者硝酸等;漏斗;CuSO4、H2SO4(化学式和名称都可以);方法二
(2)O2;2H2O
(3)Fe+CuSO4=Cu+FeSO4;置换
(4)32%
【解析】解:(1)铜屑表面呈绿色的物质化学式是Cu2(OH)2CO3 , 从组成分析,由于其是难溶性盐,所以根据复分解反应的反应物的特征(有酸可不溶,无酸需都溶),由于铜绿是难溶性的,所以发生复分解反应只能和酸反应,所以它除了能与稀硫酸反应后,还能与盐酸、硝酸等反应.操作①是固液分离,为过滤,所用的玻璃仪器有烧杯、玻璃棒和 漏斗;溶液A的溶质是过量硫酸和铜绿反应所得,所以有生成的 CuSO4和剩余的H2SO4;两种方法得到硫酸铜晶体,方法一消耗硫酸多,且是浓硫酸,不安全,同时生成了有毒的二氧化硫,所以从绿色化学的要求角度方法二更好.(2)方法二的化学反应根据质量守恒定律和给出的部分已经配平物质可推得最后的化学方程式为2Cu+2H2SO4+O2=2CuSO4+2H2O.(3)波尔多液是一种农业常用杀菌剂,它由硫酸铜、生石灰加水配制而成,不能用铁制容器来配制波尔多液的原因是铁比铜活泼,能够把铜从对应的可溶性铜盐中置换出来,降低了药效,对应的化学方程式为 Fe+CuSO4=Cu+FeSO4 , 是单质和化合物反应生成新的单质和新的化合物,为基本反应类型中的置换反应.(4)理论上废铜屑中的铜完全可以转化为硫酸铜.已知废铜屑的质量为100kg,若最后所得的硫酸铜质量为80kg,对应的铜元素的质量为80kg× ![]() ×100%=32kg,则废铜屑中铜的质量分数为
×100%=32kg,则废铜屑中铜的质量分数为 ![]() ×100%=32%.所以答案是:(1)盐酸或者硝酸等; 漏斗; CuSO4、H2SO4(化学式和名称都可以); 方法二.(2)O2 2H2O.(3)Fe+CuSO4=Cu+FeSO4; 置换.(4)32%.
×100%=32%.所以答案是:(1)盐酸或者硝酸等; 漏斗; CuSO4、H2SO4(化学式和名称都可以); 方法二.(2)O2 2H2O.(3)Fe+CuSO4=Cu+FeSO4; 置换.(4)32%.
【考点精析】本题主要考查了过滤操作的注意事项和固体溶解度曲线及其作用的相关知识点,需要掌握过滤操作注意事项:“一贴”“二低”“三靠;过滤后,滤液仍然浑浊的可能原因有:①承接滤液的烧杯不干净②倾倒液体时液面高于滤纸边缘③滤纸破损;1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和)才能正确解答此题.

 步步高达标卷系列答案
步步高达标卷系列答案【题目】在高温下,铁与水蒸气能发生反应生成一种常见铁的氧化物和一种气体,某学习小组的同学对此反应很感兴趣,在小组集体协作下设计了如图实验,以探究铁粉与水蒸气反应后的产物,也邀请你一起来完成下列探究: 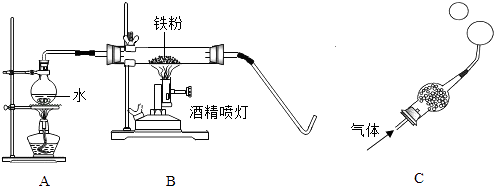
【猜想与假设】猜想一:生成的气体可能是氢气;猜想二:生成的气体可能是氧气.
【实验探究】将生成的气体通入C装置.球形管里装有碱石灰干燥剂.导管口蘸些肥皂水(或洗涤剂溶液),控制气体流速,吹出肥皂泡.当肥皂泡吹到一定大时,轻轻摆动导管,肥皂泡脱离管口后,气泡上升.用燃着的木条靠近肥皂泡,有爆鸣声.
(1)【推断】生成的气体是 .
(2)探究试管中剩余固体成分是什么? 【查阅资料】
Ⅰ.铁的氧化物①只有是Fe2O3红棕色,其余FeO、Fe3O4均为黑色;
②只有Fe3O4能被磁铁吸引.
Ⅱ.铁的氧化物都能与盐酸反应,但没有气体生成.
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引.
【猜想与假设】猜想一:剩余固体是Fe3O4;
猜想二:剩余固体是 .
(3)【实验探究】
实验操作 | 实验现象及结论 |
取少量黑色固体于试管中,加入足量 | 无气泡产生,黑色固体是 |
(4)【实验结论】铁与水蒸气反应的化学方程式为: .
(5)【拓展延伸】Ⅰ.铁、镁混合物5.6g与足量稀硫酸反应,生成的氢气质量不可能是( )
A.0.2g
B.0.3g
C.0.4g
D.0.5g
(6)Ⅱ.某同学为探究铁合金中铁的质量分数,先后进行了四次实验(铁合金中除铁外,其余成分不与稀硫酸反应),实验数据如表.根据该同学的实验,试回答以下问题:
第一次 | 第二次 | 第三次 | 第四次 | |
所取合金的质量∕g | 10 | 10 | 20 | 30 |
所加稀硫酸的质量∕g | 100 | 120 | 80 | X |
生成氢气的质量∕g | 0.2 | 0.2 | 0.2 | Y |
表中第四次实验中,合金里的铁恰好与稀硫酸完全反应,则其中X=Y= .
(7)该铜铁合金中铁的质量分数是多少?(写出计算过程)