题目内容
(2009?云南)请用“>”、“=”或“<”填空:(1)PH:氢氧化钠溶液______氯化钠溶液
(2)氧元素的质量分数:Na2O______Na2O3
(3)相对分子质量:H2CO3______HNO3
(4)一个分子中原子总数:NH3______SO3.
【答案】分析:(1)根据氢氧化钠溶液呈碱性而氯化钠溶液呈中性,比较两溶液的pH大小;
(2)根据化学式利用组成元素的质量分数= ×100%,计算两物质中O元素的质量分数并比较大小;
×100%,计算两物质中O元素的质量分数并比较大小;
(3)根据化学式利用相对分子质量为分子中各原子的相对原子质量与原子个数的积的总和,计算各物质的相对分子质量并比较大小;
(4)根据化学式判断分子的构成,比较两种分子中原子个数的多少.
解答:解:(1)氢氧化钠溶液呈碱性,其pH>7;氯化钠溶液呈中性,其pH=7;
故答案为:>;
(2)Na2O中氧元素的质量分数=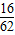 ×100%≈25.8%;Na2O3中氧元素的质量分数=
×100%≈25.8%;Na2O3中氧元素的质量分数=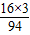 ×100%≈51.1%;
×100%≈51.1%;
故答案为:<;
(3)H2CO3相对分子质量=1×2+12+16×3=62;HNO3相对分子质量=1+14+16×3=63;
故答案为:<;
(4)一个NH3分子中原子总数=1+3=4;一个SO3分子中原子总数=1+3=4;
故答案为:=.
点评:溶液的酸碱性与溶液pH的关系为:碱性溶液,其pH>7;中性溶液,其pH=7;酸性溶液,其pH<7.
(2)根据化学式利用组成元素的质量分数=
 ×100%,计算两物质中O元素的质量分数并比较大小;
×100%,计算两物质中O元素的质量分数并比较大小;(3)根据化学式利用相对分子质量为分子中各原子的相对原子质量与原子个数的积的总和,计算各物质的相对分子质量并比较大小;
(4)根据化学式判断分子的构成,比较两种分子中原子个数的多少.
解答:解:(1)氢氧化钠溶液呈碱性,其pH>7;氯化钠溶液呈中性,其pH=7;
故答案为:>;
(2)Na2O中氧元素的质量分数=
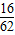 ×100%≈25.8%;Na2O3中氧元素的质量分数=
×100%≈25.8%;Na2O3中氧元素的质量分数=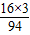 ×100%≈51.1%;
×100%≈51.1%;故答案为:<;
(3)H2CO3相对分子质量=1×2+12+16×3=62;HNO3相对分子质量=1+14+16×3=63;
故答案为:<;
(4)一个NH3分子中原子总数=1+3=4;一个SO3分子中原子总数=1+3=4;
故答案为:=.
点评:溶液的酸碱性与溶液pH的关系为:碱性溶液,其pH>7;中性溶液,其pH=7;酸性溶液,其pH<7.

练习册系列答案
相关题目
(2009?云南)某课外兴趣小组的同学设计了如下三个实验来验证质量守恒定律:

实验I:称量镁条,在空气中点燃,待反应结束后,将生成物全部收回再称量.
实验II:将装有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将盐酸与锌粒接触,过一会在称量.
实验III:将装有氢氧化钠溶液的试管放入盛有硫酸铜的锥形瓶中,并在锥型瓶口塞上橡皮塞,称量,然后设法将两种溶液接触(有蓝色氢氧化铜沉淀和硫酸钠生成)过一会再称量.数据见下表:
(1)在实验I中,反应后的质量比反应前明显增加,请用质量守恒定律加以解释______
______.
(2)实验II中发生反应的化学方程式为______,该反应属于基本反应类型中的______反应.
(3)这三个实验中,实验III正确反映了反应物与生成物之间的质量关系.请从分子、原子的角度解释反应前后质量相等的原因______.
(4)实验I、II不能正确反映反应物和生成物之间的质量关系,选一例说明实验设计中的不当之处,并提出改进思路______.

实验I:称量镁条,在空气中点燃,待反应结束后,将生成物全部收回再称量.
实验II:将装有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将盐酸与锌粒接触,过一会在称量.
实验III:将装有氢氧化钠溶液的试管放入盛有硫酸铜的锥形瓶中,并在锥型瓶口塞上橡皮塞,称量,然后设法将两种溶液接触(有蓝色氢氧化铜沉淀和硫酸钠生成)过一会再称量.数据见下表:
| 编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
| 反应前/g | 4.8 | 112.6 | 118.4 |
| 反应后/g | 8.0 | 112.4 | 118.4 |
______.
(2)实验II中发生反应的化学方程式为______,该反应属于基本反应类型中的______反应.
(3)这三个实验中,实验III正确反映了反应物与生成物之间的质量关系.请从分子、原子的角度解释反应前后质量相等的原因______.
(4)实验I、II不能正确反映反应物和生成物之间的质量关系,选一例说明实验设计中的不当之处,并提出改进思路______.
 B
B C,其中A、X是单质,B、C为化合物.根据相关信息,请回答下列问题:
C,其中A、X是单质,B、C为化合物.根据相关信息,请回答下列问题: