题目内容
 为测定碳酸氢钠纯度(含有少量氯化钠),某学生拟用如图实验装置,以下实验设计正确的是( )
为测定碳酸氢钠纯度(含有少量氯化钠),某学生拟用如图实验装置,以下实验设计正确的是( )| A、可用稀盐酸代替稀硫酸 | B、量气管中液体为水 | C、反应完全后,冷却,读取量气管体积数,再减去所加硫酸的体积,即为生成的气体体积 | D、实验测得该试样中碳酸氢钠质量分数偏高,可能是测定气体体积时未冷却至室温 |
分析:A、盐酸具有挥发性,影响生成的二氧化碳体积的测量;
B、根据二氧化碳在水中溶解性进行分析;
C、气体体积的读数就是量气管量气前的读数减去量气后的读数,液面以凹液面为准;
D、测定气体体积时未冷却至室温,温度高气体的体积变大.
B、根据二氧化碳在水中溶解性进行分析;
C、气体体积的读数就是量气管量气前的读数减去量气后的读数,液面以凹液面为准;
D、测定气体体积时未冷却至室温,温度高气体的体积变大.
解答:解:A、由于盐酸具有挥发性,生成的二氧化碳中会带有氯化氢,氯化氢能够和饱和碳酸氢钠溶液反应生成二氧化碳,对测量二氧化碳的体积会产生影响,所以使用稀硫酸,故A错误;
B、由于二氧化碳能够溶于水,量气管中的液体不能是水,应该选用饱和碳酸氢钠溶液,故B错误;
C、测量时,量气管量气之后保持水准管要和量气管液面相平,这样测出来的气体体积才是当时大气压下的体积,量气管的两次读数差就是生成气体体积,故C错误;
D、由于温度高气体体积变大,导致测定结果偏高,故D正确;
故选D.
B、由于二氧化碳能够溶于水,量气管中的液体不能是水,应该选用饱和碳酸氢钠溶液,故B错误;
C、测量时,量气管量气之后保持水准管要和量气管液面相平,这样测出来的气体体积才是当时大气压下的体积,量气管的两次读数差就是生成气体体积,故C错误;
D、由于温度高气体体积变大,导致测定结果偏高,故D正确;
故选D.
点评:本题考查了探究碳酸氢钠的纯度方法,注意合理分析实验设计的原理,作出合理分析,本题难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
[查阅资料]
<资料1>该厂采用“侯氏制碱法”生产的化工产品为纯碱(化学式为 )和氯化铵.
(“侯氏制碱法”是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺.)
<资料2>生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
<资料3>部分生产流程如下图所示.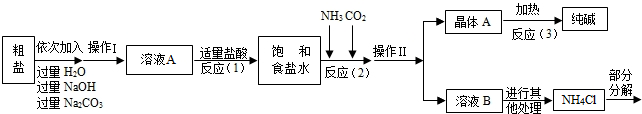
上述流程中涉及的部分反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
Na2CO3+CaCl2=CaCO3↓+2NaCl;NH4Cl═NH3↑+HCl↑
生产原理:将氨气(NH3)和二氧化碳通入饱和食盐水中得到小苏打和氯化铵的混合物,其反应的化学方程式为:NaCl(饱和溶液)+NH3+CO2+H2O=NaHCO3(晶体)↓+NH4Cl;分离出NaHCO3,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为 .
【问题讨论】
(1)溶液A中的溶质为 ,操作Ⅱ的名称为 .
(2)上述生产流程中可循环使用的是 (填序号).
A.CO2B.NH3C.HCl D.NaOH E.Na2CO3
(3)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠.
【含量测定】
同学们为了测定该纯碱样品的纯度,设计了如下实验.
甲组:取10.0g纯碱样品(假定杂质在整个实验过程中不发生变化),向其中加入过量的盐酸,直至样品中无气泡冒出.充分加热蒸发所得物质并干燥、冷却至室温后称量,所得固体质量为10.9g.样品中碳酸钠的质量分数为 (结果保留一位小数).
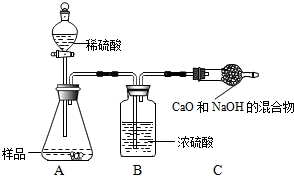
乙组:取10.0g纯碱样品,利用右图所示装置,测出反应后装置C增重了3.5g(所加试剂均足量).
实验结束后,发现乙组测定的质量分数偏小,其原因是 .
[查阅资料]
<资料1>该厂采用“侯氏制碱法”生产的化工产品为纯碱(化学式为
(“侯氏制碱法”是我国近代著名科学家侯德榜发明的一种连续生产纯碱与氯化铵的联合制碱工艺.)
<资料2>生产原料粗盐中含有少量可溶性杂质(MgCl2和CaCl2)及不溶性杂质.
<资料3>部分生产流程如下图所示.

上述流程中涉及的部分反应的化学方程式为:MgCl2+2NaOH=Mg(OH)2↓+2NaCl;
Na2CO3+CaCl2=CaCO3↓+2NaCl;NH4Cl═NH3↑+HCl↑
生产原理:将氨气(NH3)和二氧化碳通入饱和食盐水中得到小苏打和氯化铵的混合物,其反应的化学方程式为:NaCl(饱和溶液)+NH3+CO2+H2O=NaHCO3(晶体)↓+NH4Cl;分离出NaHCO3,使其充分受热即可分解制得纯碱及两种常见的氧化物,此反应的化学方程式为
【问题讨论】
(1)溶液A中的溶质为
(2)上述生产流程中可循环使用的是
A.CO2B.NH3C.HCl D.NaOH E.Na2CO3
(3)根据上述信息,请你设计实验区分碳酸钠和碳酸氢钠.
| 实验步骤 | 实验现象 | 实验结论 |
同学们为了测定该纯碱样品的纯度,设计了如下实验.

甲组:取10.0g纯碱样品(假定杂质在整个实验过程中不发生变化),向其中加入过量的盐酸,直至样品中无气泡冒出.充分加热蒸发所得物质并干燥、冷却至室温后称量,所得固体质量为10.9g.样品中碳酸钠的质量分数为
乙组:取10.0g纯碱样品,利用右图所示装置,测出反应后装置C增重了3.5g(所加试剂均足量).
实验结束后,发现乙组测定的质量分数偏小,其原因是

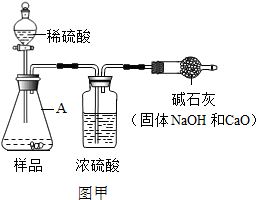 (2013?丽水)工业烧碱具有较好的杀菌消毒作用且廉价易得,但工业烧碱中常含有杂质碳酸钠.某科学学习小组同学围绕工业烧碱样品纯度测定问题,展开了讨论与探究.
(2013?丽水)工业烧碱具有较好的杀菌消毒作用且廉价易得,但工业烧碱中常含有杂质碳酸钠.某科学学习小组同学围绕工业烧碱样品纯度测定问题,展开了讨论与探究.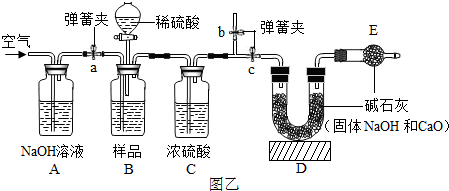 图乙B装置中样品在与稀硫酸反应前和停止反应后,都要通过量的空气,反应前通空气时a、b、c三个弹簧夹的开闭情况是
图乙B装置中样品在与稀硫酸反应前和停止反应后,都要通过量的空气,反应前通空气时a、b、c三个弹簧夹的开闭情况是
