题目内容
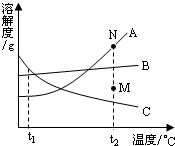
a、b、c三种物质的溶解度曲线如图所示.下列说法正确的是

- A.t1℃时,a、b、c三种物质的溶解度由大到小的顺序是b>a>c
- B.t2℃时,30ga物质加入到50g水中不断搅拌,所得溶液溶质质量分数为37.5%
- C.t2℃时,将相同质量的a、b、c三种物质的饱和溶液降温到t1℃,析出晶体最多的是a
- D.将t1℃时c的饱和溶液升温到t2℃,变为不饱和溶液
C
分析:A、根据某一温度时物质溶解度的比较方法考虑;B、根据该温度下的溶解度考虑是否全部溶解;C、根据溶解度变化范围(减小的范围)大析出晶体就多考虑;D、根据C物质溶解度曲线考虑.
解答:A、从t1℃向上做垂线,与曲线的交点在上面的溶解度就大,所以t1℃时它们的溶解度大小顺序是b>a═c,故A错;
B、t2℃时,a物质溶解度是50g,所以加入30g,只能溶解25g,质量分数为 ×100%=33.3%,故B错;
×100%=33.3%,故B错;
C、溶解度变化范围(减小的范围)大析出晶体就多,由图示可知a曲线减小的范围大析出的最多,c物质降温后变为不饱和,不能析出晶体,故C正确;
D、由于c曲线溶解度随温度的升高而减小,所以升温后,溶解度减小,会析出晶体,所以仍然是饱和溶液,故D错.
故选C.
点评:通过回答本题知道了溶解度曲线表示的意义,知道了溶解度如何比较大小,析出晶体多少的影响因素,了解了溶质质量分数的计算方法.
分析:A、根据某一温度时物质溶解度的比较方法考虑;B、根据该温度下的溶解度考虑是否全部溶解;C、根据溶解度变化范围(减小的范围)大析出晶体就多考虑;D、根据C物质溶解度曲线考虑.
解答:A、从t1℃向上做垂线,与曲线的交点在上面的溶解度就大,所以t1℃时它们的溶解度大小顺序是b>a═c,故A错;
B、t2℃时,a物质溶解度是50g,所以加入30g,只能溶解25g,质量分数为
 ×100%=33.3%,故B错;
×100%=33.3%,故B错;C、溶解度变化范围(减小的范围)大析出晶体就多,由图示可知a曲线减小的范围大析出的最多,c物质降温后变为不饱和,不能析出晶体,故C正确;
D、由于c曲线溶解度随温度的升高而减小,所以升温后,溶解度减小,会析出晶体,所以仍然是饱和溶液,故D错.
故选C.
点评:通过回答本题知道了溶解度曲线表示的意义,知道了溶解度如何比较大小,析出晶体多少的影响因素,了解了溶质质量分数的计算方法.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 6、下图为A、B、C三种物质的溶解度曲线,试回答下列问题:
6、下图为A、B、C三种物质的溶解度曲线,试回答下列问题: (2013?广东模拟)“
(2013?广东模拟)“ ”、“
”、“ ”、“
”、“ ”分别表示A、B、C三种物质的原子,下列关于如图说法正确的是( )
”分别表示A、B、C三种物质的原子,下列关于如图说法正确的是( )
 (2012?吴中区三模)如图是a、b、c三种物质的溶解度曲线,回答下列问题:
(2012?吴中区三模)如图是a、b、c三种物质的溶解度曲线,回答下列问题: