题目内容
12. 在1000mL稀盐酸(密度认为与水相同)另加入混合均匀的NaHCO3和KHCO3固体粉末,充分反应后使气体全部逸出.如图是加入粉末的质量与产生CO2质量的关系.请计算:
在1000mL稀盐酸(密度认为与水相同)另加入混合均匀的NaHCO3和KHCO3固体粉末,充分反应后使气体全部逸出.如图是加入粉末的质量与产生CO2质量的关系.请计算:(1)该盐酸中HCl的质量分数.
(2)若该盐酸为1200mL时,加入粉末为130g,求产生CO2的质量.
(3)若粉末的质量为xg,盐酸的体积为1400mL,产生的CO2的质量为yg.试写出粉末质量 x(g)与产生的CO2 质量 之间的关系.
分析 (1)根据对应的化学方程式找出盐酸和生成的二氧化碳的质量关系求算盐酸的质量分数;
(2)根据90g粉末对应1000mL稀盐酸,求算130g粉末对应的盐酸,进而判断粉末和盐酸的过量问题,进而根据完全反应的物质的数据求算二氧化碳的质量;
(3)根据(2)中分析求算1400mL盐酸恰好完全反应对应的粉末的质量,然后对粉末质量进行分析.
解答 解:
(1)设稀盐酸中HCl的质量分数为x
根据反应NaHCO3+HCl═NaCl+H2O+CO2↑和KHCO3+HCl═KCl+H2O+CO2↑可得HCl~~~CO2↑
则HCl~~~CO2↑
36.5 44
1000gx 44g
$\frac{36.5}{44}$=$\frac{1000gx}{44g}$
x=3.65%
(2)由图可以看出90g粉末和1000mL稀盐酸恰好完全反应生成44g二氧化碳.若130g粉末完全反应则应该消耗稀盐酸为$\frac{1000mL}{90g}$×130g=1444mL,而给出的盐酸为1200mL,则粉末过量,按照稀盐酸计算,则反应1200mL稀盐酸生成的二氧化碳的质量为$\frac{44g}{1000mL}$×1200mL=52.8g.
(3)根据(2)的分析,1400mL稀盐酸恰好完全反应消耗的粉末的质量为$\frac{90g}{1000mL}$×1400mL=126g,此时对应的二氧化碳的质量为$\frac{44g}{90g}$×126g=61.6g.
所以当x<126时,生成的二氧化碳的质量为$\frac{44g}{90g}$×xg=$\frac{22}{45}x$g
当x≥126时,生成的二氧化碳的质量为44g
答:
(1)该盐酸中HCl的质量分数为3.65%.
(2)若该盐酸为1200mL时,加入粉末为130g,产生CO2的质量为52.8g.
(3)若粉末的质量为xg,盐酸的体积为1400mL,产生的CO2的质量为yg.当x<126时,生成的二氧化碳的质量为$\frac{22}{45}x$g
当x≥126时,生成的二氧化碳的质量为44g.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.

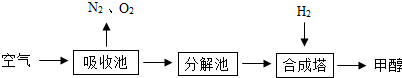
(说明:合格塔内的反应条件为高温并加催化剂.)则下列推断中不正确的是( )
| A. | 该流程可以减轻碳的排放,缓解大气温室效应 | |
| B. | 合成塔中发生反应的化学方程式是:CO2+3H2$?_{高温高压}^{催化剂}$CH3OH+H2O | |
| C. | 吸收池中发生的是化合反应,分解池中发生的是分解反应,合成塔中发生的是置换反应 | |
| D. | 吸收池中是盛饱和碳酸钾溶液,分解池中的是碳酸氢钾溶液 |
| A. | 分解反应 | B. | 化合反应 | C. | 复分解反应 | D. | 置换反应 |
| A. | 用淬火后的钢针弯成鱼钩钓鱼 | |
| B. | 用钢丝球擦洗铝锅表面的污垢 | |
| C. | 用食盐水除去铁锅内的铁锈 | |
| D. | 硝酸铵溶于水制成的冰袋可用于给发烧的病人降温 |
| A. | 二氧化硫 | B. | 一氧化碳 | C. | 二氧化碳 | D. | 氨气 |
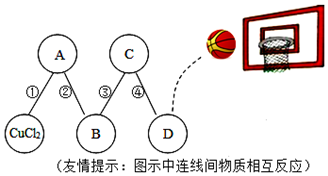
 人类每年要问自然界索取大量的金属矿物资源,金属的用途与它们的物理性质和化学性质都有着密切的关系,请回答下列问题:
人类每年要问自然界索取大量的金属矿物资源,金属的用途与它们的物理性质和化学性质都有着密切的关系,请回答下列问题: