题目内容
4.天气预报时,下列指标不会预报的是( )| A. | 二氧化碳浓度 | B. | 二氧化硫浓度 | C. | PM2.5 | D. | 氮氧化合物浓度 |
分析 空气污染物主要有两个:有害气体和粉尘.有害气体主要有一氧化碳、二氧化硫、二氧化氮等气体;粉尘主要指一些固体小颗粒.空气质量报告的主要内容包括:空气污染指数;首要污染物,包括可吸入颗粒物、二氧化硫、二氧化氮等气体;空气质量级别;空气质量状况等.空气污染指数的大小与空气质量的关系是:指数越大,空气质量状况越差;指数越小,空气的质量越好.
解答 解:A、二氧化碳不属于空气质量检测的内容,所以不需要检测二氧化碳浓度;
B、二氧化硫容易造成酸雨,属于空气质量检测的内容;
C、PM2.5属于可吸入颗粒物,属于空气污染物,属于空气质量检测的内容.
D、二氧化氮会污染空气,属于空气质量检测的内容;
故选A
点评 本题主要是考查空气质量报告的内容,环保问题已经引起了全球的重视,关于“三废”的处理问题,是中考的热点问题,化学上提倡绿色化学工艺,要从源头上杜绝污染.本考点基础性强,主要出现在选择题和填空题中.

练习册系列答案
相关题目
14..探究空气的组成:我们每时每刻都生活在空气的海洋里,了解空气生活将更美好.如图是探究空气中氧气体积的实验:

(1)连接A装置后,点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧.
①记录现象:红磷燃烧,有大量白烟生成,集气瓶内的水面上升.
②实验结论:红磷燃烧的化学表达式为4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
③实验分析:
实验中采用过量红磷消耗氧气,而不采用木炭、硫磺,是因为红磷在空气中燃烧生成五氧化二磷固体,而木炭、硫磺在空气中燃烧生成二氧化碳气体和二氧化硫气体;从图中可以观察到实验产生了误差,原因可能是燃烧匙伸入集气瓶中时太慢 (写一点即可)
(2)科学家通过大量的实验已经证明了①空气的成分按体积分数计算,大约是:氮气占78%,氧气占21%,稀有气体占0.94%,二氧化碳占0.03%,其他气体和杂质占0.03%.
(3)兴趣小组的同学设计了B装置,连接处细玻璃管内放有铜丝,加热时交替缓慢推动两个注射器活塞是为了使装置中的氧气充分反应;
停止加热后冷却至室温,将气体全部推至一只注射器中,读出注射器内气体的体积.
比较A和B两个装置,B装置的实验读数更为准确,这是因为避免了燃烧匙伸入集气瓶过程中导致的气体外逸.

(1)连接A装置后,点燃燃烧匙内的红磷,伸入集气瓶中并把塞子塞紧.
①记录现象:红磷燃烧,有大量白烟生成,集气瓶内的水面上升.
②实验结论:红磷燃烧的化学表达式为4P+5O2$\frac{\underline{\;点燃\;}}{\;}$2P2O5.
③实验分析:
实验中采用过量红磷消耗氧气,而不采用木炭、硫磺,是因为红磷在空气中燃烧生成五氧化二磷固体,而木炭、硫磺在空气中燃烧生成二氧化碳气体和二氧化硫气体;从图中可以观察到实验产生了误差,原因可能是燃烧匙伸入集气瓶中时太慢 (写一点即可)
(2)科学家通过大量的实验已经证明了①空气的成分按体积分数计算,大约是:氮气占78%,氧气占21%,稀有气体占0.94%,二氧化碳占0.03%,其他气体和杂质占0.03%.
(3)兴趣小组的同学设计了B装置,连接处细玻璃管内放有铜丝,加热时交替缓慢推动两个注射器活塞是为了使装置中的氧气充分反应;
停止加热后冷却至室温,将气体全部推至一只注射器中,读出注射器内气体的体积.
| 反应前注射器内气体的体积 | 反应后注射器内气体的体积 | 消耗掉的氧气体积 |
| 30mL | 24 mL | 6 mL |
15.根据实践经验,下列说法错误的是( )
| A. | 用冷碟子收集蜡烛火焰上方的炭黑 | B. | 用明矾除去水中的异味 | ||
| C. | 用白醋除去热水瓶胆里的水垢 | D. | 用铁粉做食品干燥剂 |
12.下列说法正确的是( )
| A. | 高炉炼铁中所需的高温和CO的生成都与焦炭有关 | |
| B. | 为了加强食品的色、香、味,可以大量使用添加剂 | |
| C. | 洗洁精能够洗去餐具上的油污,因为洗洁精能够溶解油污 | |
| D. | 饱和澄清石灰水受热后变浑浊,因为氢氧化钙的溶解度随温度升高而增大 |
16.除去下列物质中的杂质所选用的试剂及操作方法中不正确的是( )
| 物质 | 所含杂质 | 选用的试剂和操作方法 | |
| A | NaCl溶液 | Na2CO3 | 加入过量的稀盐酸后蒸发 |
| B | CO2 | CO | 使气体缓缓通过足量灼热的氧化铜 |
| C | CuO | Cu | 放入足量稀硫酸中,充分反应后过滤 |
| D | FeCl2溶液 | CuCl2 | 向溶液中加入过量铁屑,充分搅拌后过滤 |
| A. | A | B. | B | C. | C | D. | D |
14.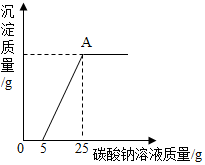 为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①②③④),每份样品分别与一定量的稀盐酸反应,所得数据如下表所示:
为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①②③④),每份样品分别与一定量的稀盐酸反应,所得数据如下表所示:
然后,为了探究石灰石与稀盐酸反应后所得废液中的溶质成分,将编号 ③所得废液过滤,取滤液质量的$\frac{1}{4}$于烧杯中,向其中滴加质量分数为10.6%的碳酸钠溶液使其充分反应直至过量,有关的变化如图所示:分析题中有关信息和图象,回答下列问题:
(1)石灰石样品的纯度为80%.
(2)图象中5-25阶段发生的反应方程式是CaCl2+Na2CO3═CaCO3↓+2NaCl.
(3)编号③所用稀盐酸的质量m为85g (要写计算过程)
 为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①②③④),每份样品分别与一定量的稀盐酸反应,所得数据如下表所示:
为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①②③④),每份样品分别与一定量的稀盐酸反应,所得数据如下表所示:| 样品编号 | ① | ② | ③ | ④ |
| 稀盐酸的质量 | 20g | 40g | m(80<m<130)g | 130g |
| 剩余固体的质量 | 8g | 6g | 2g | 2g |
(1)石灰石样品的纯度为80%.
(2)图象中5-25阶段发生的反应方程式是CaCl2+Na2CO3═CaCO3↓+2NaCl.
(3)编号③所用稀盐酸的质量m为85g (要写计算过程)

 临近中午她饿了,她打开了自带的即热饭盒,其内部结构如图所示.需要加热食物时,让盒内的水与生石灰接触即可,此反应的化学方程式为CaO+H2O=Ca(OH)2.
临近中午她饿了,她打开了自带的即热饭盒,其内部结构如图所示.需要加热食物时,让盒内的水与生石灰接触即可,此反应的化学方程式为CaO+H2O=Ca(OH)2.