题目内容
2、溶液的酸碱度测定:溶液的酸碱度可以用
使紫色石蕊溶液变红的溶液一定是
pH试纸
来测定,用pH
表示,当pH=0时溶液呈酸
性.测定溶液pH需要用到的仪器主要有玻璃棒
,如果测定前用水润湿试纸,溶液的pH变化是酸偏大碱偏小
.使紫色石蕊溶液变红的溶液一定是
酸性
溶液,使无色酚酞变红的溶液一定是碱性
溶液,碳酸钾和碳酸钠从物质类别上说属于盐
,但它们的溶液呈碱
性,能使无色酚酞试液变红
.分析:①溶液的酸碱度用pH表示,常用的测定方法是使用pH试纸,pH<7时,溶液显酸性.
②若测定前用水润湿试纸,会稀释被测液,使溶液的酸性或碱性减弱.
③酸溶液一定能使紫色石蕊溶液变红,但能使石蕊溶液变红的溶液不一定是酸溶液,只能说一定是酸性溶液.因为酸一定显酸性,但显酸性的溶液不一定是酸溶液,碱溶液一定显碱性,但显碱性的溶液不一定是碱溶液.例如纯碱碳酸钠属于盐,但它的水溶液显碱性.
②若测定前用水润湿试纸,会稀释被测液,使溶液的酸性或碱性减弱.
③酸溶液一定能使紫色石蕊溶液变红,但能使石蕊溶液变红的溶液不一定是酸溶液,只能说一定是酸性溶液.因为酸一定显酸性,但显酸性的溶液不一定是酸溶液,碱溶液一定显碱性,但显碱性的溶液不一定是碱溶液.例如纯碱碳酸钠属于盐,但它的水溶液显碱性.
解答:解:溶液的酸碱度一般用pH表示,当溶液的pH=0时溶液呈酸性,常用的测定方法是使用pH试纸,测量时用玻璃棒蘸取被测液滴到pH试纸上将试纸显示的颜色与标准比色卡比较所得的数值就是溶液的pH.若测定前用水润湿试纸,会稀释被测液,使酸性溶液的pH偏大,碱性溶液的pH偏小.
使紫色石蕊溶液变红的溶液一定是酸性溶液,使无色酚酞变红的溶液一定是碱性溶液,碳酸钾和碳酸钠从物质类别上说虽然属于盐,但它们的溶液呈碱性,能使无色酚酞试液变红.
故答案为:pH试纸,pH,酸,玻璃棒,酸偏大碱偏小.酸性,碱性,盐,碱,红.
使紫色石蕊溶液变红的溶液一定是酸性溶液,使无色酚酞变红的溶液一定是碱性溶液,碳酸钾和碳酸钠从物质类别上说虽然属于盐,但它们的溶液呈碱性,能使无色酚酞试液变红.
故答案为:pH试纸,pH,酸,玻璃棒,酸偏大碱偏小.酸性,碱性,盐,碱,红.
点评:本题考查溶液的酸碱度的测定方法和酸碱指示剂的使用,特别要注意:酸与酸性,碱与碱性使用时应准确描述,不能混淆.

练习册系列答案
相关题目
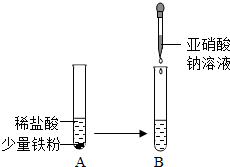
 亚硝酸钠(化学式为NaN02)是一种常用的防腐剂.亚硝酸钠是一种淡黄色或白色晶体,有咸味,易潮解,易溶于水,其水溶液呈碱性;在320℃时能分解产生氧化钠固体、一氧化氮气体和一种常见的助燃性气体.亚硝酸钠有毒性,能将人体血红蛋白中的+2价亚铁离子转
亚硝酸钠(化学式为NaN02)是一种常用的防腐剂.亚硝酸钠是一种淡黄色或白色晶体,有咸味,易潮解,易溶于水,其水溶液呈碱性;在320℃时能分解产生氧化钠固体、一氧化氮气体和一种常见的助燃性气体.亚硝酸钠有毒性,能将人体血红蛋白中的+2价亚铁离子转