题目内容
某温度下含MgCl246.8%的饱和溶液中,加入4.6g无水MgCl2,最终析出水合晶体40.6g,则该水合晶体的化学式是
- A.MgCl2?2H2O
- B.MgCl2?5H2O
- C.MgCl2?6H2O
- D.MgCl2?9H2O
B
分析:根据原溶液为饱和溶液,则加入4.6g无水MgCl2,最终析出水合晶体40.6g,可知从饱和溶液中出来的质量为(40.6-4.6)g,即该36g溶液为饱和溶液,根据质量分数计算溶质和溶剂的质量,再利用水合晶体40.6g中MgCl2和水的质量来确定化学式.
解答:因向饱和溶液中加入4.6g无水MgCl2,析出水合晶体40.6g,
则从饱和溶液中出来的质量为(40.6-4.6)g=36g,
36g溶液中溶质MgCl2的质量为36g×46.8%=16.8g,
水的质量为36g-16.8g=19.2g,
则40.6g晶体中MgCl2的质量为4.6g+16.8g=21.4g,水的质量为19.2g,
MgCl2的相对分子质量为95,水的相对分子质量为18,则
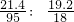 ≈1:5
≈1:5
即化学式为MgCl2?5H2O,故选B.
点评:本题考查水合晶体化学式的确定,习题较难,学生应正确分析从饱和溶液中出来的组成仍然是饱和的组成,然后利用定组成的方法来确定化学式.
分析:根据原溶液为饱和溶液,则加入4.6g无水MgCl2,最终析出水合晶体40.6g,可知从饱和溶液中出来的质量为(40.6-4.6)g,即该36g溶液为饱和溶液,根据质量分数计算溶质和溶剂的质量,再利用水合晶体40.6g中MgCl2和水的质量来确定化学式.
解答:因向饱和溶液中加入4.6g无水MgCl2,析出水合晶体40.6g,
则从饱和溶液中出来的质量为(40.6-4.6)g=36g,
36g溶液中溶质MgCl2的质量为36g×46.8%=16.8g,
水的质量为36g-16.8g=19.2g,
则40.6g晶体中MgCl2的质量为4.6g+16.8g=21.4g,水的质量为19.2g,
MgCl2的相对分子质量为95,水的相对分子质量为18,则
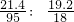 ≈1:5
≈1:5即化学式为MgCl2?5H2O,故选B.
点评:本题考查水合晶体化学式的确定,习题较难,学生应正确分析从饱和溶液中出来的组成仍然是饱和的组成,然后利用定组成的方法来确定化学式.

练习册系列答案
相关题目
某温度下含MgCl246.8%的饱和溶液中,加入4.6g无水MgCl2,最终析出水合晶体40.6g,则该水合晶体的化学式是( )
| A、MgCl2?2H2O | B、MgCl2?5H2O | C、MgCl2?6H2O | D、MgCl2?9H2O |