题目内容
(2006?赤峰)有一包固体粉末由CaCO3、Na2SO4、BaCl2、CuSO4中的两种物质组成,取样品进行如下实验:
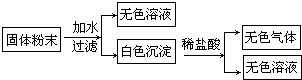
从实验可以判断,该固体粉末中一定含有

从实验可以判断,该固体粉末中一定含有
CaCO3
CaCO3
,一定不含有CuSO4
CuSO4
.写出白色沉淀与稀盐酸反应的化学方程式:CaCO3+2HCl═CaCl2+CO2↑+H2O
CaCO3+2HCl═CaCl2+CO2↑+H2O
.分析:根据盐的性质进行判断,在这包固体粉末由CaCO3、Na2SO4、BaCl2、CuSO4中,只有CaCO3是沉淀,难溶于水;取样品加水,得到无色溶液,则能排除CuSO4,因为CuSO4溶于水,显蓝色.
解答:解:有一包固体粉末由CaCO3、Na2SO4、BaCl2、CuSO4中的两种物质组成,取样品加水,出现白色沉淀,该固体粉末中一定含有CaCO3,只有CaCO3是沉淀,难溶于水;取样品加水,得到无色溶液,该固体粉末中一定不含有CuSO4,因为CuSO4溶于水,显蓝色;白色沉淀与稀盐酸反应的化学方程式为CaCO3+2HCl═CaCl2+CO2↑+H2O.
故答案为:CaCO3;CuSO4;CaCO3+2HCl═CaCl2+CO2↑+H2O
故答案为:CaCO3;CuSO4;CaCO3+2HCl═CaCl2+CO2↑+H2O
点评:本题考查盐的性质及鉴别.CaCO3难溶于水,在水中能得到白色沉淀.

练习册系列答案
相关题目

