题目内容
将干燥的铁粉和氧化铁粉末的混合物
30g放入玻璃管中,通入一氧化碳并加热,待氧化铁完全反应后,残留的固体质量是27g,求此混合物中氧化铁的质量是多少?解析:
|
解:设混合物中有 Fe2O3为x g,则含铁为(30-x)g;27g残余固体中含有没有反应的原有铁和反应生成的铁,反应生成的铁为:[27g-(30g-x)]g.则:Fe2O3+3CO 160 112 x 27g-(30g-x) 160∶112=x∶[27g-(30g-x)] ∴ x=10g答:混合物中含氧化铁为 10g. |

 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案
|
|
②氯酸钾和氯化钾均能溶于水。
【实验一】氧化铁能否在氯酸钾制取氧气实验中加快反应速率。
| 实验编号 | KClO3/g | 氧化物 | 产生气体的体积(mL) | 耗时(s) |
| 1 | 0.6 |
| 67 | 1800 |
| 2 | 0.6 | 0.2g二氧化锰 | 67 | 36.5 |
| 3 | 0.6 | g 氧化铁 | 67 | 89.5 |
⑴实验3中氧化铁的质量为 。
⑵以上实验采用了 的实验方法。
⑶实验一得到的结论是 。
【实验二】为证明氧 化铁是该反应的催化剂,同学们又完成了以下的实验:
化铁是该反应的催化剂,同学们又完成了以下的实验:
Ⅰ.在实验3反应后的混合物中加足量的水溶解,过滤得到红色固体,洗涤干燥并用电子天平称量,质量为0.2g。
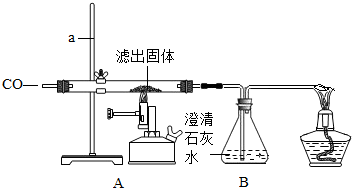
Ⅱ.将一定量的CO通入滤出的固体,按下图进行实验:
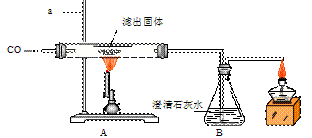
甲同学的实验 报告如下:
报告如下:
| 装置 | 实验现象 | 实验分析 |
| A | 红色固体全部变黑 | 生成了铁 |
| B | 石灰水变浑浊 | 产生二氧化碳 |
⑷写出A中玻璃管内发生反应的化学方程式 。
【实验结论】氧化铁能在氯酸钾制取氧气反应中起催化剂。
【实验反思】乙同学查阅资料发现一氧化碳还原氧化铁后剩余固体可能由氧化亚铁、四氧化三铁、铁粉和未反应的氧化铁中的一种或几种组成。
为了研究剩余固体的成分,丙同学查阅了以下资料:
| 铁粉 | 氧化亚铁 | 氧化铁 | 四氧化三铁 | |
| 颜色 | 黑色 | 黑色 | 红色 | 黑色 |
| 磁性 | 有 | 无 | 无 | 有 |
| 与CO反应 | 不反应 | 反应 | 反应 |
|
| 与稀盐酸反应 | 反应 | 生成氯化亚铁和水 | 生成氯化铁和水 | 生成氯化亚铁、氯化铁和水 |
| 与硫酸铜溶液 | 反应 | 不反应 | 不反应 | 不反应 |
⑸丙同学认为剩余固体中一定没有氧化铁,原因是____________。
⑹测定剩余固体的组成。
| 步骤 | 实验操作 | 实验现象 | 结论和解释 |
| 1 | 用磁铁吸引剩余固体 | _____________ | 剩余固体中没有氧化亚铁。 |
| 2 | __________________ | ______________ | 剩余固体中只有铁粉。 |





 反应
反应