题目内容
1.a、b、c三种酸分别与足量的金属Mg充分反应,生成等质量的H2,反应消耗a、b、c的分子数目之比为3:6:2.下列关于a、b、c的推理合理的是(HX、H2Y、H3Z分别表示三种酸)( )| A. | a、b、c可能分别为H3Z、HX、H2Y | B. | a、b、c可能分别为H2Y、H3Z、HX | ||
| C. | a、b、c可能分别为 HX、H3Z、H2Y | D. | a、b、c•可能分别为 H2Y、HX、H3Z |
分析 根据三种酸分别与镁反应的方程式,结合反应的酸的分子数目之比分析酸的种类结合选项进行分析得出正确的结论.
解答 解:2HX+Mg=MgX2+H2↑,H2Y+Mg=MgY+H2↑,2H3Z+3Mg=Mg3Z2+3H2↑,生成氢气相等,说明消耗的氢原子的个数相等,假设产生的氢原子的个数都是6个,则消耗的HX的分子6个,消耗H2Y的分子个数为3,消耗H3Z的分子个数为2个,因此反应消耗a、b、c的分子数目之比为3:6:2,相对于的酸及分子个数关系是3H2Y、6HX、2H3Z,所以a、b、c分别为H2Y、HX、H3Z,故选:D.
点评 本题考查了金属与酸的反应,以反应表达式的形式出现,要注意和对应的实际的酸对应进行分析,难度较大.

练习册系列答案
相关题目
11.下列不属于化学变化的是( )
| A. | 干冰升华 | B. | 烧碱露置在空气中 | ||
| C. | 食物腐败 | D. | 钢铁锈蚀 |
12.物质的宏观性质与微观组成(或结构)相互联系是化学特有的思维方式,下列对物质性质的 解释不正确的是( )
| A. | 稀有气体可以用作多种用途的电光源,是因为它们的化学性质比较稳定 | |
| B. | 铁桶不能盛放波尔多液,是因为铁能与硫酸铜溶液反应 | |
| C. | 金刚石、石墨的物理性质差异较大,是因为碳原子的排列方式不同 | |
| D. | 氢氧化钾溶液、石灰水都能使石蕊试液变蓝,是因为它们都含有OH- |
16.下列图形能正确反映实验事实的是( )
| A. |  向接近饱和的KNO3溶液中加入KNO3固体 | |
| B. | 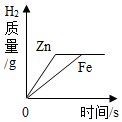 等质量的Zn、Fe分别与足量等质量分数的稀硫酸反应 | |
| C. | 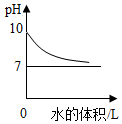 常温下向pH=10的氢氧化钠溶液中加水稀释 | |
| D. | 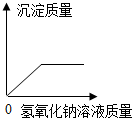 硫酸铜和硫酸混合液滴入氢氧化钠溶液 |
6.下列反应中不属于复分解反应的是( )
| A. | H2SO4+Ca(OH)2═CaSO4+2H2O | B. | Na2SO4+BaCl2═BaSO4↓+2NaCl | ||
| C. | CO2+Ca(OH)2═CaCO3↓+H2O | D. | 2HCl+CaCO3═CaCl2+H2O+CO2↑ |
13.下列物质名称、化学式、俗名不相符的一组是( )
| A. | 氢氧化钠-NaOH-火碱 | B. | 碳酸钠-Na2CO3-纯碱 | ||
| C. | 碳酸氢钠-NaHCO3-小苏打 | D. | 氧化钙-CaO-熟石灰 |
13.在实验事实的基础上归纳结论,是化学学习的重要思想和方法.下列有关金属活动性实验探究的归纳和总结中.不科学的是( )
| A. | 铝与氧气在常温下不能反应,而铁与氧气在高温时才能反应,故铝比铁活泼 | |
| B. | 锌片与盐酸反应比铁片与稀硫酸反应要剧烈,故锌比铁活泼 | |
| C. | 镁能与盐酸反应放出氢气,而铜不能与盐酸反应,故镁比铜活泼 | |
| D. | 铜与硝酸银溶液反应得到银,故铜比银活泼 |
14. 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a.可能与金属本身的性质有关
b.可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入等质量、等浓度的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡.写出锌与盐酸发生反应的化学方程式为Zn+2HCl=ZnCl2+H2↑.
从实验现象可判断:金属活动性Zn>Fe(填“<”、’“=”或“>”).
【得出结论】金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是金属活动性越强,反应越剧烈.
实验(2)为探究猜想b,小组同学设计如上图的装置进行实验,其中注射器的作用是通过注射器往右移动的体积测得生成氢气的体积.
所用药品、实验数据如表:
【得出结论】金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是其他条件相同时,盐酸浓度越大,反应越剧烈.
【反思评价】根据表中实验Ⅱ数据分析,请解释锌与盐酸发生反应由慢到快、再由快到慢的原因是锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.
【拓展延伸】通过以上探究,你认为金属与盐酸反应的剧烈程度还可能与哪些因素有关?请你帮助他们继续探究.(只要求提出一种影响快慢的相关假设因素及实验方案)
【假设】金属与盐酸反应的剧烈程度与金属表面积大小有关.
【实验方案】分别取等质量的锌片和锌粉于试管中,分别加入等体积等浓度的稀盐酸,观察产生气泡的快慢.(假设与方案要对应合理即可).
 化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.
化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究.【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a.可能与金属本身的性质有关
b.可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入等质量、等浓度的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡.写出锌与盐酸发生反应的化学方程式为Zn+2HCl=ZnCl2+H2↑.
从实验现象可判断:金属活动性Zn>Fe(填“<”、’“=”或“>”).
【得出结论】金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是金属活动性越强,反应越剧烈.
实验(2)为探究猜想b,小组同学设计如上图的装置进行实验,其中注射器的作用是通过注射器往右移动的体积测得生成氢气的体积.
所用药品、实验数据如表:
| 实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 1分钟 | 1-2分钟 | 2-3分钟 | 3-4分钟 | 4-5分钟 | 前5分钟共收集气体 | |||
| Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 48.5 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
【反思评价】根据表中实验Ⅱ数据分析,请解释锌与盐酸发生反应由慢到快、再由快到慢的原因是锌与稀盐酸反应放热,随着反应的进行,温度升高,所以速度越来越快,一段时间后,盐酸被消耗,盐酸浓度变小,反应速率减慢.
【拓展延伸】通过以上探究,你认为金属与盐酸反应的剧烈程度还可能与哪些因素有关?请你帮助他们继续探究.(只要求提出一种影响快慢的相关假设因素及实验方案)
【假设】金属与盐酸反应的剧烈程度与金属表面积大小有关.
【实验方案】分别取等质量的锌片和锌粉于试管中,分别加入等体积等浓度的稀盐酸,观察产生气泡的快慢.(假设与方案要对应合理即可).
 某同学用如图所示实验装置探究分子的性质,请问能否通过实验现象得出分子在不断运动的结论?请说明理由.
某同学用如图所示实验装置探究分子的性质,请问能否通过实验现象得出分子在不断运动的结论?请说明理由.