题目内容
已知:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
CO(g)+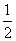 O2(g)===CO2(g) ΔH=-282.8 kJ·mol-1
O2(g)===CO2(g) ΔH=-282.8 kJ·mol-1
现有CO、H2、CO2组成的混合气体67.2L(标准状况),经完全燃烧后放出的总热量为710.0 kJ,并生成18 g液态水,则燃烧前混合气体中CO的体积分数为( )
A.80% B.50% C.60% D.20%
答案 B
解析 根据生成18 g液态H2O知混合气体中含1 mol H2,该反应产生的热量为 kJ=285.8 kJ。CO燃烧放出的热量为710.0 kJ-285.8 kJ=424.2 kJ,则CO的物质的量为n(CO)=
kJ=285.8 kJ。CO燃烧放出的热量为710.0 kJ-285.8 kJ=424.2 kJ,则CO的物质的量为n(CO)= =1.5 mol,V(CO)%=
=1.5 mol,V(CO)%=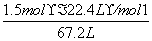 ×100%=50%。
×100%=50%。

 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案用下图装置进行电解实验(a、b、c、d均为铂电极),供选择的有4组电解液,要满足下列要求:
| 组 | A槽 | B槽 |
| 1 | NaOH | CuSO4 |
| 2 | AgNO3 | CuCl2 |
| 3 | Na2SO4 | AgNO3 |
| 4 | NaCl | AgNO3 |
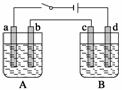
①工作一段时间后,A槽pH上升,B槽的pH下降;
②b、c两极上反应的离子的物质的量相等。
(1)应选择的电解质是上述四组中的第____组。
(2)该组电解过程中各电极上的电极反应为
a极: ________________________________________________________________,
b极: ________________________________________________________________,
c极: ________________________________________________________________,
d极: ________________________________________________________________。
(3)当b极上析出7.1 g电解产物时,a极上析出产物的质量为________ g;若B槽电解质溶液为500 mL,且忽略电解前后电解液的体积变化,则此时B槽中的c(H+)比电解前增加了
________ mol·L-1。
 O2(g)===2CO2(g)+H2O(l)
O2(g)===2CO2(g)+H2O(l)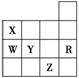 A.常压下五种元素的单质中Z单质的沸点最高
A.常压下五种元素的单质中Z单质的沸点最高