题目内容
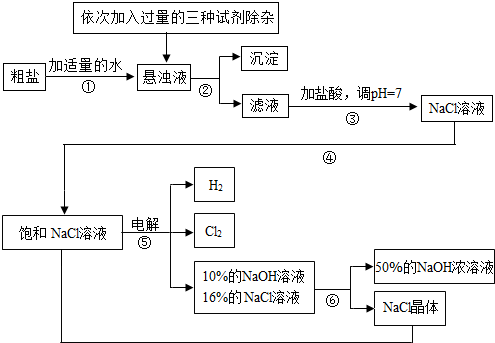
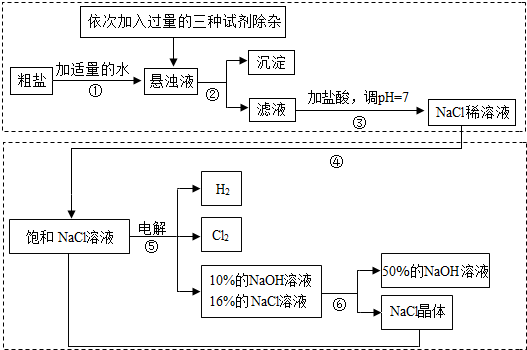
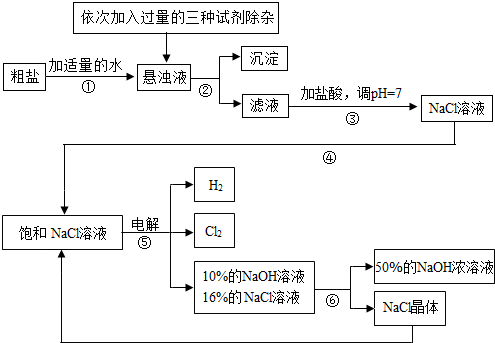
以电解食盐水为基础制取氯气、氢氧化钠等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一.由于粗盐中含有少量MgCl2、CaCl2、Na2SO4等杂质,不符合电解要求,因此必须经过精制.以粗盐为原料的“氯碱工业”流程如下:
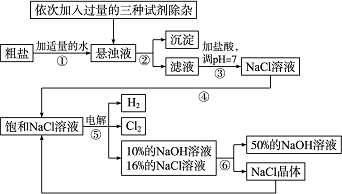
回答下列问题:
(1)氯气、氢氧化钠在工业上有广泛的用途.下列关于氢氧化钠的描述中,错误的是________.
A.能去除油污,可作厨房清洁剂
B.易溶于水,溶解时放出大量的热
C.水溶液能使石蕊溶液变红
D.可用作某些气体的干燥剂
(2)操作②的名称是________,操作④的名称是________.
(3)操作①②间除杂质时所加的三种试剂是NaOH溶液、Na2CO3溶液、BaCl2溶液(均过量),其顺序要求是:Na2CO3溶液必须在BaCl2溶液之________(填“前”或“后”)加入.有同学提出用________溶液代替BaCl2溶液可达到同样的目的.
(4)电解饱和NaCl溶液的化学方程式是________.
(5)该流程中可以循环利用的物质是________.
解析:
|
解析:(1)氢氧化钠溶液能使石蕊溶液变蓝;(2)把悬浊液中的沉淀、滤液分开其操作是过滤,NaCl溶液变为饱和NaCl溶液可进行蒸发;(3)把粗盐中MgCl2、CaCl2、Na2SO4等杂质除去,Na2CO3溶液必须在BaCl2溶液之后加入,目的是除去多余的BaCl2;Ba(OH)2与Na2SO4反应生成BaSO4沉淀和NaOH,故用Ba(OH)2溶液来代替BaCl2溶液可达到同样目的;(4)NaCl和H2O通电生成NaOH、H2和Cl2;(5)由流程可知,NaCl可循环利用. 答案:(1)C (2)过滤 蒸发 (3)后 Ba(OH)2 (4)2NaCl+2H2O (5)NaCl |

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案