题目内容
非物质文化遗产“芜湖铁画”(镀金)含有金、铁(其他成分忽略不计),某同学想测量其含金量,于是取一定质量的铁画边角料,加入足量稀硫酸,使它们充分反应,具体数据如下表所示,请计算:
反应前物质的质量/g 充分反应后物质的质量/g
铁画边角料 稀硫酸 剩余固体和液体的总质量
8.5 170 178.2
(1)产生气体的质量为 g;
(2)样品中铁的质量是多少?
(3)样品中金的质量分数是多少?(结果保留一位小数)
【考点】根据化学反应方程式的计算.
【专题】有关化学方程式的计算;综合计算(图像型、表格型、情景型计算题).
【分析】因为金、铁这两种元素,只有铁可以和盐酸发生反应,产生氢气,根据质量守恒定律,反应前后减少的质量为生成的氢气的质量,根据化学方程式得出反应物之间的比例式,求出铁的质量,即可求出金的质量.
【解答】解:(1)因为金、铁这两种元素,只有铁可以和盐酸发生反应,产生氢气,根据质量守恒定律,反应前后减少的质量为生成的氢气的质量,氢气的质量=8.5g+170g﹣178.2g=0.3g;
(2)设铁画边角料中所含铁的质量为x.
Fe+2HCl=FeCl2+H2↑
56 2
x 0.3g


x=8.4g
样品中金的质量分数=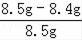
 ×100%≈1.2%.
×100%≈1.2%.
答案:
(1)0.3;
(2)样品中铁的质量是8.4g;
(3)样品中金的质量分数是1.2%
【点评】本题主要考查学生对铁生锈条件的认识,以及对物质质量分数的计算能力.学生必须熟知所给物质的性质,才能正确分析发生反应的过程,据此判计算物质质量,进而计算出质量分数.

 阅读快车系列答案
阅读快车系列答案要学会从化学的视角认识世界,对下列事实的解释错误的是( )
| 事实 | 解释 | |
| A | 香水、汽油要密封保存 | 分子不断地运 动 |
| B | 湿衣服晾在太阳底下干得快 | 分子运动速率与温度有关 |
| C | 6000L氧气加压可装入容积为40L的钢瓶 | 分子之间有间隙 |
| D | 物体热胀冷缩 | 分子大小随温度而改变 |
A.A B.B C.C D.D