题目内容
将铜和活泼金属R的合金5g,放入25g20%的稀盐酸中,恰好完全反应,经测定R的氯化物中氯元素的质量分数为52.2%,则样品中金属R的质量分数约为
- A.96%
- B.89%
- C.45%
- D.29%
B
分析:根据质量守恒定律,化学反应前后元素的种类和质量不变,求出25g 20%的盐酸中氯元素的质量也就是求出生成的盐中氯元素的质量,进而求出生成的盐中R元素的质量,也就是金属R的质量,最后根据R的质量金属样品的质量×100%求出样品中R的质量分数.
解答:盐酸中氯元素的质量=25g×20%×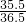 =4.863g;
=4.863g;
生成的盐中氯元素的质量分数为52.2%,则生成的盐中R元素的质量分数也为47.8%,
生成的盐中R元素的质量为:4.863g× =4.453g.
=4.453g.
样品中R的质量分数= ×100%=89%.
×100%=89%.
故选B.
点评:本题是一道特殊的有关化学方程式的计算题,解题关键是质量守恒定律的应用.
分析:根据质量守恒定律,化学反应前后元素的种类和质量不变,求出25g 20%的盐酸中氯元素的质量也就是求出生成的盐中氯元素的质量,进而求出生成的盐中R元素的质量,也就是金属R的质量,最后根据R的质量金属样品的质量×100%求出样品中R的质量分数.
解答:盐酸中氯元素的质量=25g×20%×
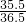 =4.863g;
=4.863g;生成的盐中氯元素的质量分数为52.2%,则生成的盐中R元素的质量分数也为47.8%,
生成的盐中R元素的质量为:4.863g×
 =4.453g.
=4.453g.样品中R的质量分数=
 ×100%=89%.
×100%=89%.故选B.
点评:本题是一道特殊的有关化学方程式的计算题,解题关键是质量守恒定律的应用.

练习册系列答案
相关题目
下列现象及事实与相应的解释不一致的是
| 现 象 及 事 实 | 解 释 | |
| A | 100mL酒精和100mL水混合后,体积小于200mL | 分子是有质量的 |
| B | 酒香不怕巷子深 | 分子是运动的 |
| C | 测出氢氧化钠溶液pH>7,其溶液显碱性 | 溶液中存在大量OH- |
| D | 水通电后,电解生成氢气和氧气 | 分子是可以再分的 |
- A.选A
- B.选B
- C.选C
- D.选D
下面观点都是错误的,请用化学式或化学方程式写出相应的否定例证.
| 错 误 观 点 | 否 定 例 证 | |
| ① | 含有氧元素的化合物一定是氧化物 | ________(其他合理答案均给分). |
| ② | 生成盐和水的反应一定是中和反应 | ________(其他合理答案均给分) |
 :
: 以下是探究水的组成的实验.右图是电解水实验的示意图.
以下是探究水的组成的实验.右图是电解水实验的示意图.