题目内容
 某兴趣小组在实验室中用如图所示装置模拟炼铁的化学原理,并测定赤铁矿中氧化铁的质量分数(装置气密性良好,反应完全且赤铁矿中的杂质不参加反应,称量赤铁矿样品的质量为wg).
某兴趣小组在实验室中用如图所示装置模拟炼铁的化学原理,并测定赤铁矿中氧化铁的质量分数(装置气密性良好,反应完全且赤铁矿中的杂质不参加反应,称量赤铁矿样品的质量为wg). ①装置A中生成铁的化学方程式为
②要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是
考点:一氧化碳还原氧化铁,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:①一氧化碳在高温下还原氧化铁生成铁和二氧化碳;二氧化碳能使澄清的石灰水变浑浊;
②由于氧化铁与一氧化碳反应生成了铁和二氧化碳,只要测出反应后装置A中药品的质量,就可计算出反应前后减少的质量,减少的质量就是氧化铁中氧的质量,从而计算出氧化铁的质量,进而计算出氧化铁的质量分数;或测出反应前后装置B增加的质量,即生成的二氧化碳的质量,根据二氧化碳的质量再计算出氧化铁的质量,进而计算出氧化铁的质量分数.
②由于氧化铁与一氧化碳反应生成了铁和二氧化碳,只要测出反应后装置A中药品的质量,就可计算出反应前后减少的质量,减少的质量就是氧化铁中氧的质量,从而计算出氧化铁的质量,进而计算出氧化铁的质量分数;或测出反应前后装置B增加的质量,即生成的二氧化碳的质量,根据二氧化碳的质量再计算出氧化铁的质量,进而计算出氧化铁的质量分数.
解答:解:①一氧化碳在高温下还原氧化铁生成铁和二氧化碳,反应的化学方程式是:Fe2O3+3CO
2Fe+3CO2;二氧化碳能与氢氧化钙反应生成碳酸钙沉淀和水;
②由于氧化铁与一氧化碳反应生成了铁和二氧化碳,只要测出反应后装置A中药品的质量,就可计算出反应前后减少的质量,减少的质量就是氧化铁中氧的质量,从而计算出氧化铁的质量,进而计算出氧化铁的质量分数;或测出反应前后装置B增加的质量,即生成的二氧化碳的质量,根据二氧化碳的质量再计算出氧化铁的质量,进而计算出氧化铁的质量分数.所以,要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是装置A在反应前后的质量变化或装置B在反应前后的质量变化.
故答案为:①Fe2O3+3CO
2Fe+3CO2;CO2+Ca(OH)2=CaCO3↓+H2O;
②反应后装置A中药品的质量;测出反应前后装置B增加的质量.
| ||
②由于氧化铁与一氧化碳反应生成了铁和二氧化碳,只要测出反应后装置A中药品的质量,就可计算出反应前后减少的质量,减少的质量就是氧化铁中氧的质量,从而计算出氧化铁的质量,进而计算出氧化铁的质量分数;或测出反应前后装置B增加的质量,即生成的二氧化碳的质量,根据二氧化碳的质量再计算出氧化铁的质量,进而计算出氧化铁的质量分数.所以,要测定该赤铁矿样品中氧化铁的质量分数,需要测量的数据是装置A在反应前后的质量变化或装置B在反应前后的质量变化.
故答案为:①Fe2O3+3CO
| ||
②反应后装置A中药品的质量;测出反应前后装置B增加的质量.
点评:本题考查的是铁的冶炼的知识,完成此题,可以依据已有的知识进行.

练习册系列答案
相关题目
垃圾应分类回收,生活中废弃的铁锅、铝制易拉罐、铜导线可以归为一类加以回收,它们属于( )
| A、化合物 | B、金属可回收物 |
| C、氧化物 | D、盐 |
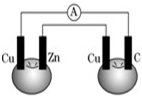
小明在一次家庭实验时,将铜片和锌片用导线连接后插入番茄里,如图所示,电流计指针发生偏转,可见番茄液内含有( )

| A、自由移动的离子 |
| B、自由移动的分子 |
| C、自由移动的原子 |
| D、自由移动的电子 |
在研究物质的气味时,某同学进行了如图所示的操作.下列说法不正确的是( )


| A、这种研究物质的方法属于实验法 |
| B、这是闻物质气味的正确操作 |
| C、该操作可以区分酒精和白醋 |
| D、该操作利用了分子间有间隔的性质 |
 如图是甲、乙两种固体物质的溶解度曲线.
如图是甲、乙两种固体物质的溶解度曲线.