题目内容
17.下列化学反应及反应类型与如图所示的微观变化对应正确的是( )
| A. | 2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2 化合反应 | |
| B. | 2HI+Cl2═2HCl+I2 置换反应 | |
| C. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ 分解反应 | |
| D. | 2HCl+CuO═CuCl+H2O 复分解反应 |
分析 根据物质的微观构成及反应的微粒数目关系分析,该反应反应为:单质+化合物→单质+化合物.故可推测答案.
解答 解:由所示的微观变化图示可知,各物质反应的微粒数目关系是:
由上图可知,此反应的特点为:单质+化合物→单质+化合物.因此该反应为置换反应,则:
A、2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2,此反应不符合“单质+化合物→单质+化合物”的特点,故A错误;
B、2HI+Cl2=2HCl+I2,此反应符合“单质+化合物→单质+化合物”的置换反应特点,故B正确;
C、2H2O$\frac{\underline{\;点燃\;}}{\;}$2H2↑+O2↑,此反应不符合“单质+化合物→单质+化合物”的特点,故C错误;
D、2HCl+CuO═CuCl2+H2O,此反应不符合“单质+化合物→单质+化合物”的特点,故D错误.
故选B.
点评 本题主要考查了如何根据微观示意图来判断反应类型问题.在读图过程中能将图中干扰因素去除是解题的关键;

练习册系列答案
相关题目
5. 碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
查阅资料:获得的资料有:
(1)补钙剂中常加入糖类、维生素D等改善口感或增强药效.这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解.
(2)碳酸钙高温灼烧分解生成氧化钙和二氧化碳.
(3)常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量.
(4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15gCa(OH)2.
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定.
方案1:根据如图所示装置实验.
(1)锥形瓶中发生反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)长颈漏斗下部插入液面下的目的是防止CO2气体逸出(液封).
(3)加入药品前,检验该装置气密性的方法是夹住胶管(堵住导管出口),从长颈漏斗加水至长颈漏斗中液面高于锥形瓶内液面,若一段时间不下降,则证明该装置气密性良好;
分析和评价.
(4)记录数据如下:
方案2:将钙片粉碎,加入足量的稀盐酸充分反应,根据放出气体的量计算碳酸钙的含量.记录数据如下(空烧杯质量为100g,加入钙片质量为25g):
【分析和评价】
(1)方案1和方案2中合理的是方案2,原因是澄清石灰水中的Ca(OH)2含量很少(不足),吸收的二氧化碳量很少.
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(假设实验室可以进行该实验),原因是加入的糖类、维生素D等物质高温灼烧时会燃烧或分解,导致最终的数据偏大.
(3)要使用查阅资料(3)中介绍的方法,还需要学习的是如何测定未知浓度(剩余)盐酸的量.
【结论】经过计算,该钙片中碳酸钙的质量分数是60%.
 碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.
碳酸钙可用于预防和治疗钙缺乏症.某实验小组同学要测定一种钙片中碳酸钙的含量.查阅资料:获得的资料有:
(1)补钙剂中常加入糖类、维生素D等改善口感或增强药效.这些物质不与稀盐酸反应产生气体,高温灼烧时会燃烧或分解.
(2)碳酸钙高温灼烧分解生成氧化钙和二氧化碳.
(3)常见的碳酸钙含量测定方法:将碳酸钙粉碎,加入已知浓度的过量盐酸充分反应,然后测剩余盐酸的量,根据消耗盐酸的量最终求得碳酸钙的含量.
(4)澄清石灰水中的Ca(OH)2含量很少,100g澄清石灰水中最多含0.15gCa(OH)2.
【方案设计和实施】根据资料和已学知识,该小组同学设计如下两种方案进行测定.
方案1:根据如图所示装置实验.
(1)锥形瓶中发生反应的化学方程式为CaCO3+2HCl═CaCl2+H2O+CO2↑.
(2)长颈漏斗下部插入液面下的目的是防止CO2气体逸出(液封).
(3)加入药品前,检验该装置气密性的方法是夹住胶管(堵住导管出口),从长颈漏斗加水至长颈漏斗中液面高于锥形瓶内液面,若一段时间不下降,则证明该装置气密性良好;
分析和评价.
(4)记录数据如下:
| 钙片质量 | 空洗气瓶质量 | 澄清石灰水的质量 | 反应后洗气瓶及瓶内物质总质量 |
| 25g | 100g | 200g | 300.4g |
| 加入稀盐酸的质量 | 100g | 200g | 300g | 400g |
| 充分反应后烧杯及杯内物质总质量 | 222.8g | 320.6g | 418.4g | 518.4g |
(1)方案1和方案2中合理的是方案2,原因是澄清石灰水中的Ca(OH)2含量很少(不足),吸收的二氧化碳量很少.
(2)该小组同学没有使用碳酸钙高温灼烧分解的方法(假设实验室可以进行该实验),原因是加入的糖类、维生素D等物质高温灼烧时会燃烧或分解,导致最终的数据偏大.
(3)要使用查阅资料(3)中介绍的方法,还需要学习的是如何测定未知浓度(剩余)盐酸的量.
【结论】经过计算,该钙片中碳酸钙的质量分数是60%.
9.化学影响着社会的发展和人们的生活质量,以下说法正确的是( )
| A. | 将草木灰和碳铵混合施用有利于提高肥效 | |
| B. | 为了加强食品的色、香、味,可以大量使用添加剂 | |
| C. | 不能在铁制容器中配置波尔多液农药 | |
| D. | 焚烧废旧塑料可以解决“白色污染”问题 |
6.以下几种实验操作,正确的是( )
| A. |  称量固体NaOH | B. | 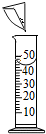 在量筒内配制食盐水 | ||
| C. | 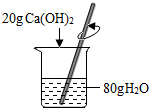 配制20%的Ca(OH)2溶液 | D. | 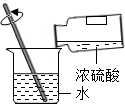 将浓H2SO4稀释成稀H2SO4 |
7.下列说法正确的是( )
| A. | 无色透明的液体一定是溶液 | |
| B. | 配制溶液时,搅拌可以加大固体物质的溶解度 | |
| C. | 厨房清洁剂(主要成分:NaOH)去油污的原理:乳化去油污 | |
| D. | “冬天捞碱”的原理:降温结晶 |

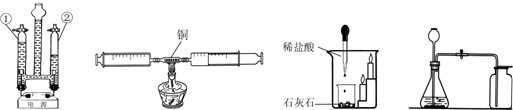
 某化学兴趣小组的同学在探究铝、铜、铁三种金属的有关性质时,进行了如图实验:在A实验中发生反应的化学方程式为Fe+CuSO4=Cu+FeSO4.将A实验结束后①、②试管内的物质倒入烧杯中,发现烧杯中的红色固体物质明显增多,一段时间后过滤.滤渣中:一定含有的物质是铜,可能含有的物质是铁.为了进一步确定可能有的物质是否存在,同学们向滤渣中滴加稀盐酸,结果没有气泡产生,那么滤液中含有的金属离子可能是②⑤(填写序号).
某化学兴趣小组的同学在探究铝、铜、铁三种金属的有关性质时,进行了如图实验:在A实验中发生反应的化学方程式为Fe+CuSO4=Cu+FeSO4.将A实验结束后①、②试管内的物质倒入烧杯中,发现烧杯中的红色固体物质明显增多,一段时间后过滤.滤渣中:一定含有的物质是铜,可能含有的物质是铁.为了进一步确定可能有的物质是否存在,同学们向滤渣中滴加稀盐酸,结果没有气泡产生,那么滤液中含有的金属离子可能是②⑤(填写序号).