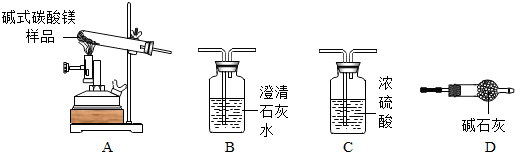
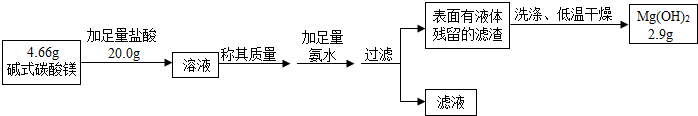
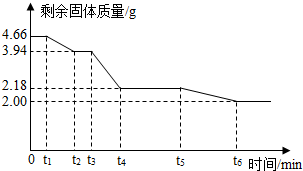
题目内容
钙原子在化学反应中易 (“得”或“失”)电子,形成钙离子 (符号)
考点:原子和离子的相互转化,化学符号及其周围数字的意义
专题:物质的微观构成与物质的宏观组成
分析:依据该原子的最外层电子数的特点判断化学反应中得失电子的情况以及离子的书写;
解答:解:由于钙原子的最外层电子数为2,在化学反应中易失掉最外层的这两个电子,所以钙离子的符号为Ca2+;
故答案为:失;Ca2+;
故答案为:失;Ca2+;
点评:此题是对原子结构特点的考查,解题的关键是呢能够利用该原子的最外层电子数特点对其性质的掌握.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列在厨房中发生的变化是物理变化的是( )
| A、榨取果汁 | B、冬瓜腐烂 |
| C、铁锅生锈 | D、煤气燃烧 |
互为同素异形体的一组物质是( )
| A、氧气与液氧 | B、水银与银 |
| C、干冰与冰 | D、金刚石与石墨 |


 某研究小组发现,维C泡腾片(保健药品,见图1)溶于水时,有许多气泡产生(如图2).该小组同学进行如下探究.
某研究小组发现,维C泡腾片(保健药品,见图1)溶于水时,有许多气泡产生(如图2).该小组同学进行如下探究. (1)按下列要求选择序号填空.
(1)按下列要求选择序号填空.