题目内容
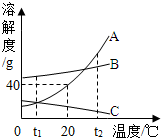 (2013?塘沽区二模)如图为A、B、C三种物质的溶解度曲线,据图回答:
(2013?塘沽区二模)如图为A、B、C三种物质的溶解度曲线,据图回答:(1)将t2℃时三种物质等质量的饱和溶液分别降温到0℃时,析出溶质最多的是
A
A
.(2)20℃时,将30g A物质放入50g水中,充分搅拌,所得溶液的质量是
70
70
g.(3)若将t1℃三种物质的饱和溶液分别升温到t2℃时,则三种溶液中溶质的质量分数由大到小的顺序是
B>A>C
B>A>C
.分析:(1)等质量的饱和溶液降温相同的温度,溶解度变化大的析出晶体多;
(2)据20℃时A的溶解度分析回答;
(3)据三种物质的溶解度随温度变化情况及饱和溶液中溶质的质量分数计算方法,分析溶液中溶质的质量分数变化.
(2)据20℃时A的溶解度分析回答;
(3)据三种物质的溶解度随温度变化情况及饱和溶液中溶质的质量分数计算方法,分析溶液中溶质的质量分数变化.
解答:解:(1)观察图示可知:C的溶解度随温度的降低而增大,故降温无溶质析出,在t2℃~0℃范围内,A的溶解度明显比B的溶解度变化大,所以将t2℃时三种物质等质量的饱和溶液分别降温到0℃时,析出溶质最多的是 A;
(2)20℃时A的溶解度是40g,所以将30g A物质放入50g水中,充分搅拌最多溶解20g,所得溶液的质量是 70g;
(3)AB的溶解度随温度的升高而增大,C的溶解度随温度的升高而减小,所以若将t1℃三种物质的饱和溶液分别升温到t2℃时,AB的溶解度不变,与升温前相等,C析出晶体,溶质质量分数减小;据饱和溶液中溶质质量分数的计算式
×100%可知:溶解度越大质量分数也就越大,t1℃时B的溶解度大于A大于t2℃时C的溶解度,则三种溶液中溶质的质量分数由大到小的顺序是B>A>C;
故答案为:(1)A;(2)70 g; (3)B>A>C.
(2)20℃时A的溶解度是40g,所以将30g A物质放入50g水中,充分搅拌最多溶解20g,所得溶液的质量是 70g;
(3)AB的溶解度随温度的升高而增大,C的溶解度随温度的升高而减小,所以若将t1℃三种物质的饱和溶液分别升温到t2℃时,AB的溶解度不变,与升温前相等,C析出晶体,溶质质量分数减小;据饱和溶液中溶质质量分数的计算式
| 溶解度 |
| 溶解度+100g |
故答案为:(1)A;(2)70 g; (3)B>A>C.
点评:了解溶解度曲线的意义、溶解度的概念、饱和溶液中溶质的质量分数的计算方法,才能结合题意顺利分析解答相关问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2013?塘沽区二模)某化学学习小组同学在实验室中练习配制一定溶质质量分数的溶液.
(2013?塘沽区二模)某化学学习小组同学在实验室中练习配制一定溶质质量分数的溶液.