题目内容
用NaCl固体配制溶质质量分数为10%的NaCl溶液时,下列情况能使所配溶液中溶质质量分数偏大的是
- A.将NaCl固体放在托盘天平的左盘称量
- B.量取水的体积时仰视读数
- C.溶解NaCl的烧杯先用蒸馏水润洗
- D.转移NaCl固体时有水溅出烧杯
D
分析:依据溶质质量分数的计算公式:溶质质量分数=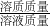 ×100%进行分析,导致溶质质量分数偏大有两大因素:溶质质量偏大、溶剂质量偏小.然后针对每个选项进行分析,判断该操作对溶质、溶剂有何影响,最后得出答案.
×100%进行分析,导致溶质质量分数偏大有两大因素:溶质质量偏大、溶剂质量偏小.然后针对每个选项进行分析,判断该操作对溶质、溶剂有何影响,最后得出答案.
解答:A、将NaCl固体放在托盘天平的左盘称量,若未用游码则结果无影响,若用到游码,则NaCl实际质量=砝码质量-游码质量,将导致NaCl质量减少,最终导致溶质质量分数偏小,故A错;
B、量取水的体积时仰视读数,会导致所得水的体积偏大,则水的质量偏大,最终导致溶质质量分数偏小,故B错;
C、溶解NaCl的烧杯先用蒸馏水润洗,会导致所用水的质量偏大,最终导致溶质质量分数偏小,故B错;
D、转移NaCl固体时有水溅出烧杯,会导致所用水的质量偏小,最终导致溶质质量分数偏大,故D对.
故选D.
点评:该题以溶液配制为载体,考查了错误或不规范操作引起的溶质质量分数变化的问题,解答时要认真分析错误操作导致的溶质或溶剂质量的改变,再结合溶质质量分数的计算公式,最后作出正确判断.
分析:依据溶质质量分数的计算公式:溶质质量分数=
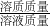 ×100%进行分析,导致溶质质量分数偏大有两大因素:溶质质量偏大、溶剂质量偏小.然后针对每个选项进行分析,判断该操作对溶质、溶剂有何影响,最后得出答案.
×100%进行分析,导致溶质质量分数偏大有两大因素:溶质质量偏大、溶剂质量偏小.然后针对每个选项进行分析,判断该操作对溶质、溶剂有何影响,最后得出答案.解答:A、将NaCl固体放在托盘天平的左盘称量,若未用游码则结果无影响,若用到游码,则NaCl实际质量=砝码质量-游码质量,将导致NaCl质量减少,最终导致溶质质量分数偏小,故A错;
B、量取水的体积时仰视读数,会导致所得水的体积偏大,则水的质量偏大,最终导致溶质质量分数偏小,故B错;
C、溶解NaCl的烧杯先用蒸馏水润洗,会导致所用水的质量偏大,最终导致溶质质量分数偏小,故B错;
D、转移NaCl固体时有水溅出烧杯,会导致所用水的质量偏小,最终导致溶质质量分数偏大,故D对.
故选D.
点评:该题以溶液配制为载体,考查了错误或不规范操作引起的溶质质量分数变化的问题,解答时要认真分析错误操作导致的溶质或溶剂质量的改变,再结合溶质质量分数的计算公式,最后作出正确判断.

练习册系列答案
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
化学研究性小组做酸碱中和实验.
Ⅰ.同学们在老师指导下,用氢氧化钠固体配制100g溶质质量分数为10%的氢氧化钠溶液.
(1)溶解时需要用到玻璃棒,其作用是______;
(2)下列操作会导致配制的氢氧化钠溶液溶质的质量分数偏低的是______(填序号)
A.氢氧化钠固体中含有不溶于水的杂质
B.用水洗净后的燃杯未干燥就直接用于配制
C.用量筒量取水的体积时采用俯视的方法读数
Ⅱ.当小组的同学将稀盐酸滴入所配制的氢氧化钠溶液进行中和实验时,发现有气泡产生,小组同学产生质疑,要对这瓶变质的氢氧化钠固体进行探究.
[分析]氢氧化钠固体曝露在空气中不仅吸收,还可以与空气中二氧化碳反应而变质,写出该反应的化学方程式______.
[猜想假设]猜想一:该氢氧化钠样品部分变质.
猜想二:该氢氧化钠样品全部变质.
[查阅资料]①已知反应:CaCl2+Na2CO3═2NaCl+CaCO3↓
②部分盐酸溶液的pH如下表:
| 盐溶液 | CaCl2溶液 | Na2CO3溶液 | NaCl溶液 |
| pH | 等于7 | 大于7 | 等于7 |
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤一:取少量样品于试管中, 加适量水振荡后全部溶解,滴 入CaCl2溶液至过量,充分反 应后,静置. | 白色沉淀 | 样品中一定含有______ |
| 步骤一:取步骤一充分反应后 的少量上层清液于试管中,滴 入无色酚酞试液至. | ______ | 结合两步实验得出 猜想一成立. |
[反思]NaOH固体应______保存.
化学研究性小组做酸碱中和实验.
Ⅰ.同学们在老师指导下,用氢氧化钠固体配制100g溶质质量分数为10%的氢氧化钠溶液.
(1)溶解时需要用到玻璃棒,其作用是______;
(2)下列操作会导致配制的氢氧化钠溶液溶质的质量分数偏低的是______(填序号)
A.氢氧化钠固体中含有不溶于水的杂质
B.用水洗净后的燃杯未干燥就直接用于配制
C.用量筒量取水的体积时采用俯视的方法读数
Ⅱ.当小组的同学将稀盐酸滴入所配制的氢氧化钠溶液进行中和实验时,发现有气泡产生,小组同学产生质疑,要对这瓶变质的氢氧化钠固体进行探究.
[分析]氢氧化钠固体曝露在空气中不仅吸收,还可以与空气中二氧化碳反应而变质,写出该反应的化学方程式______.
[猜想假设]猜想一:该氢氧化钠样品部分变质.
猜想二:该氢氧化钠样品全部变质.
[查阅资料]①已知反应:CaCl2+Na2CO3═2NaCl+CaCO3↓
②部分盐酸溶液的pH如下表:
[进行实验]请你与他们共同完成,并回答所给的问题:
[拓展]研究性小组同学在步骤二中滴加的试剂除用指示剂外,还可以用______替代.
[反思]NaOH固体应______保存.
Ⅰ.同学们在老师指导下,用氢氧化钠固体配制100g溶质质量分数为10%的氢氧化钠溶液.
(1)溶解时需要用到玻璃棒,其作用是______;
(2)下列操作会导致配制的氢氧化钠溶液溶质的质量分数偏低的是______(填序号)
A.氢氧化钠固体中含有不溶于水的杂质
B.用水洗净后的燃杯未干燥就直接用于配制
C.用量筒量取水的体积时采用俯视的方法读数
Ⅱ.当小组的同学将稀盐酸滴入所配制的氢氧化钠溶液进行中和实验时,发现有气泡产生,小组同学产生质疑,要对这瓶变质的氢氧化钠固体进行探究.
[分析]氢氧化钠固体曝露在空气中不仅吸收,还可以与空气中二氧化碳反应而变质,写出该反应的化学方程式______.
[猜想假设]猜想一:该氢氧化钠样品部分变质.
猜想二:该氢氧化钠样品全部变质.
[查阅资料]①已知反应:CaCl2+Na2CO3═2NaCl+CaCO3↓
②部分盐酸溶液的pH如下表:
| 盐溶液 | CaCl2溶液 | Na2CO3溶液 | NaCl溶液 |
| pH | 等于7 | 大于7 | 等于7 |
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤一:取少量样品于试管中, 加适量水振荡后全部溶解,滴 入CaCl2溶液至过量,充分反 应后,静置. | 白色沉淀 | 样品中一定含有______ |
| 步骤一:取步骤一充分反应后 的少量上层清液于试管中,滴 入无色酚酞试液至. | ______ | 结合两步实验得出 猜想一成立. |
[反思]NaOH固体应______保存.
化学研究性小组做酸碱中和实验.
Ⅰ.同学们在老师指导下,用氢氧化钠固体配制100g溶质质量分数为10%的氢氧化钠溶液.
(1)溶解时需要用到玻璃棒,其作用是______;
(2)下列操作会导致配制的氢氧化钠溶液溶质的质量分数偏低的是______(填序号)
A.氢氧化钠固体中含有不溶于水的杂质
B.用水洗净后的燃杯未干燥就直接用于配制
C.用量筒量取水的体积时采用俯视的方法读数
Ⅱ.当小组的同学将稀盐酸滴入所配制的氢氧化钠溶液进行中和实验时,发现有气泡产生,小组同学产生质疑,要对这瓶变质的氢氧化钠固体进行探究.
[分析]氢氧化钠固体曝露在空气中不仅吸收,还可以与空气中二氧化碳反应而变质,写出该反应的化学方程式______.
[猜想假设]猜想一:该氢氧化钠样品部分变质.
猜想二:该氢氧化钠样品全部变质.
[查阅资料]①已知反应:CaCl2+Na2CO3═2NaCl+CaCO3↓
②部分盐酸溶液的pH如下表:
[进行实验]请你与他们共同完成,并回答所给的问题:
[拓展]研究性小组同学在步骤二中滴加的试剂除用指示剂外,还可以用______替代.
[反思]NaOH固体应______保存.
Ⅰ.同学们在老师指导下,用氢氧化钠固体配制100g溶质质量分数为10%的氢氧化钠溶液.
(1)溶解时需要用到玻璃棒,其作用是______;
(2)下列操作会导致配制的氢氧化钠溶液溶质的质量分数偏低的是______(填序号)
A.氢氧化钠固体中含有不溶于水的杂质
B.用水洗净后的燃杯未干燥就直接用于配制
C.用量筒量取水的体积时采用俯视的方法读数
Ⅱ.当小组的同学将稀盐酸滴入所配制的氢氧化钠溶液进行中和实验时,发现有气泡产生,小组同学产生质疑,要对这瓶变质的氢氧化钠固体进行探究.
[分析]氢氧化钠固体曝露在空气中不仅吸收,还可以与空气中二氧化碳反应而变质,写出该反应的化学方程式______.
[猜想假设]猜想一:该氢氧化钠样品部分变质.
猜想二:该氢氧化钠样品全部变质.
[查阅资料]①已知反应:CaCl2+Na2CO3═2NaCl+CaCO3↓
②部分盐酸溶液的pH如下表:
| 盐溶液 | CaCl2溶液 | Na2CO3溶液 | NaCl溶液 |
| pH | 等于7 | 大于7 | 等于7 |
| 实验步骤 | 实验现象 | 实验结论 |
| 步骤一:取少量样品于试管中, 加适量水振荡后全部溶解,滴 入CaCl2溶液至过量,充分反 应后,静置. | 白色沉淀 | 样品中一定含有______ |
| 步骤一:取步骤一充分反应后 的少量上层清液于试管中,滴 入无色酚酞试液至. | ______ | 结合两步实验得出 猜想一成立. |
[反思]NaOH固体应______保存.