题目内容
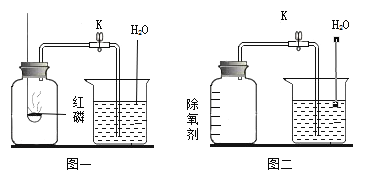
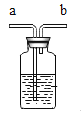
【题目】用下图所示装置测定空气中氧气的含量,已知集气瓶中空气体积为V1 mL,实验步骤如下(量筒中事先装有足量水,且装置气密性良好,部分操作已略去):

①关闭止水夹,用高能激光笔照射,引燃红磷;
②待红磷熄灭并冷却至室温,打开止水夹;测得量筒中的液面下降了V2mL;
③计算空气中氧气的体积分数。
(1)反应的化学方程式为_____。
(2)若红磷量不足可能造成测得的空气中氧气含量_____(填“偏大”、“偏小”或“不变”)。
(3)反应过程中,集气瓶中压强变化是_____。
(4)计算得出空气中氧气体积分数为_____(用含有V1、V2的计算式表示)。
(5)关于该实验下列说法不正确的是_____(填序号)。
A 用激光笔照射点燃红磷可防止集气瓶中气体逸出
B 红磷燃烧只消耗集气瓶中的氧气
C 若未冷却至室温就打开止水夹,量筒中液面下降会大于V2mL
D 反应前集气瓶中少量水的作用是防止高温物质溅落炸裂瓶底
【答案】4P+5O2![]() 2P2O5 偏小 压强先增大,后减小到大气压以下,打开止水夹后又升至大气压 V2/V1×100% CD
2P2O5 偏小 压强先增大,后减小到大气压以下,打开止水夹后又升至大气压 V2/V1×100% CD
【解析】
(1)红磷在空气中燃烧生成五氧化二磷,故填:4P+5O2![]() 2P2O5,故填:4P+5O2
2P2O5,故填:4P+5O2![]() 2P2O5;
2P2O5;
(2)若红磷量不足可能造成测得的空气中氧气含量偏小,故填:偏小;
(3)反应过程中,红磷燃烧放热,且消耗瓶内的氧气,集气瓶中压强变化是:压强先增大,后减小到大气压以下,打开止水夹后又升至大气压;故填:压强先增大,后减小到大气压以下,打开止水夹后又升至大气压;
(4)集气瓶中空气体积为V1 mL,待红磷熄灭并冷却至室温,打开止水夹;测得量筒中的液面下降了V2mL,空气中氧气的体积分数的计算式= V2/V1×100%,故填:V2/V1×100%;
(5)A 用激光笔照射点燃红磷可防止集气瓶中气体逸出,正确;
B 红磷燃烧只消耗集气瓶中的氧气,正确;
C 若未冷却至室温就打开止水夹,量筒中液面下降会小于V2mL,错误;
D 反应前集气瓶中少量水的作用是降温和吸收生成的五氧化二磷,故错误;
故选:CD。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
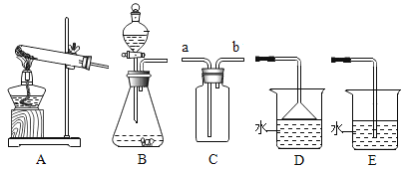
阳光同学一线名师全优好卷系列答案【题目】请根据下列实验装置图,回答问题。
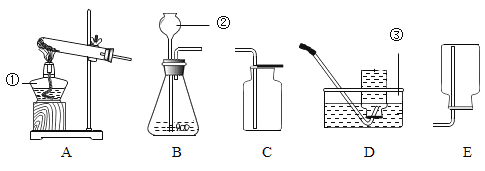
(1)实验室用双氧水和二氧化锰制取氧气的化学方程式为________________,发生装置为________(填字母序号)。若反应过于剧烈,从实验安全角度考虑,可以采取的措施有______________(写一种即可)。
(2)实验室用高锰酸钾制取氧气,为进一步研究高锰酸钾的分解产物,某兴趣小组查阅资料,并取一定质量的高锰酸钾加热使之完全分解,进行下表所示的实验。
(实验内容):
编号 | 实验内容 | 实验现象 | 实验结论 |
1 | 取反应后固体剩余物0.2g加入5mL%的H2O2溶液 | 剧烈反应,放热,产生大量气泡 | 生成物中的MnO2催化分解H2O2 |
2 | 取0. 2g MnO2加入5mL_____(填H2O2溶液的溶质质量分数)的H2O2溶液 | 平稳反应,放热,持续产生气泡 | MnO2催化分解H2O2 |
3 | 取反应后固体剩余物1. 0g,加入足量水,充分溶解,过滤 | 固体完全溶解,滤纸上无黑色固体残余物 | 固体剩余物中无_____ |
(实验分析):
①完善上表中的填空内容:实验2________,实验3________。
②实验2的目的是________。
③经讨论,实验1的结论不正确,理由是________。
(资料):在43.9℃~377.9℃范围中,KMnO4受热分解时,会发生以下两个反应:
a.![]()
b.![]()
④取8.0g KMnO4加热使之完全分解,生成O2的质量可能为________(填字母序号);
A0.81 g B1.08 g C1.42 g D1.62 g
⑤资料显示,KMnO4在43.9℃~377 .9℃范围中的失重率(O2与KMnO4的质量比)为18.0%。结合资料分析,在43.9℃~377.9℃范围中,KMnO4分解反应主要以____(填“a”或“b”)为主。