题目内容
10.向100g某稀硫酸中加入100g 20%的硫酸溶液,混合液中硫酸的质量分数变为12%,则原稀硫酸中硫酸的质量分数为( )| A. | 2% | B. | 4% | C. | 6% | D. | 8% |
分析 本题为溶液的稀释类题目,解答时可以根据溶液混合前后溶质的总质量不变来解答该题.
解答 解:根据混合前后溶液中溶质的总质量不变,
设原溶液的质量分数为x,
100g•x+100g×20%=(100g+100g)×12%
解得:x=4%
故选:B.
点评 本题主要考查学生对溶质的质量分数的含义的理解与掌握,并能灵活应用于解题.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
20.性质决定用途,下列物质的用途中,主要利用其化学性质的是 ( )
| A. | 液化气作燃料 | B. | 铜丝作导线 | ||
| C. | 干冰用于人工降雨 | D. | 铁铸造铁锅 |
18.下列实验操作没有错误的是( )
| A. |  说明气密性良好 | B. |  稀释浓硫酸 | ||
| C. |  加热 | D. |  蒸馏水制备 |
15.在相同温度下,下列四种氯化钠溶液中溶质的质量分数最大的是( )
| A. | 20g NaC1溶于80g水中 | B. | 80g NaCl溶液中含氯化钠20g | ||
| C. | 18g水中溶解2g NaCl | D. | 该温度时,NaCl的饱和溶液 |
2.做完“铁在氧气里燃烧”实验后,小冬同学有两个疑惑不解的问题,于是她进行了以下探究活动,请你一同参与.
[问题1]铁燃烧时溅落下来的黑色物质中还有没有铁呢?
[查阅资料1](1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);
(2)铁的氧化物均能溶于酸的溶液.
[实验探究]将冷却后的黑色物质碾碎,装入试管,加入稀盐酸溶液,观察到的现象是冒气泡,说明铁燃烧时溅落下来的黑色物质中还含有铁.
[问题2]铁燃烧的产物为什么不是Fe2O3呢?
[查阅资料2]
(1)Fe3O4和Fe2O3的分解温度、铁的熔点见表:
(2)Fe2O3高温时分解成Fe3O4.
[理论探讨]根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在l535℃~l538℃之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产物是Fe3O4.
[拓展延伸]
(1)铁丝燃烧的现象为剧烈燃烧,火星四射,生成一种黑色固体,放出大量热,实验前应在集气瓶中放少量水,目的是防止熔融物溅落使集气瓶炸裂.
(2)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式6Fe203$\frac{\underline{\;高温\;}}{\;}$4Fe304+02↑.
(3)有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色由黑色变成红棕色,就说明包装盒破损进气,这样售货员就能及时发现并处理.
[问题1]铁燃烧时溅落下来的黑色物质中还有没有铁呢?
[查阅资料1](1)自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);
(2)铁的氧化物均能溶于酸的溶液.
[实验探究]将冷却后的黑色物质碾碎,装入试管,加入稀盐酸溶液,观察到的现象是冒气泡,说明铁燃烧时溅落下来的黑色物质中还含有铁.
[问题2]铁燃烧的产物为什么不是Fe2O3呢?
[查阅资料2]
| Fe3O4 | Fe2O3 | 铁 | |
| 分解温度/℃ | 1538 | 1400 | - |
| 熔点/℃ | - | - | 1535 |
(2)Fe2O3高温时分解成Fe3O4.
[理论探讨]根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在l535℃~l538℃之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产物是Fe3O4.
[拓展延伸]
(1)铁丝燃烧的现象为剧烈燃烧,火星四射,生成一种黑色固体,放出大量热,实验前应在集气瓶中放少量水,目的是防止熔融物溅落使集气瓶炸裂.
(2)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式6Fe203$\frac{\underline{\;高温\;}}{\;}$4Fe304+02↑.
(3)有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色由黑色变成红棕色,就说明包装盒破损进气,这样售货员就能及时发现并处理.
20.如图是X、Y、Z三种液体的近似pH,下列判断不正确的是( )


| A. | X显酸性 | B. | Z可能是氢氧化钠溶液 | ||
| C. | Y一定是水 | D. | Z可使无色酚酞变红 |
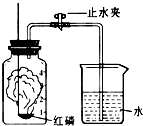 某化学兴趣小组的同学对空气中氧气含量的测定实验进行探究.
某化学兴趣小组的同学对空气中氧气含量的测定实验进行探究.