题目内容
200g稀盐酸与25g含碳酸钙80%的石灰石恰好完全反应,化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,试计算:(1)生成二氧化碳气体的质量;
(2)稀盐酸中溶质的质量分数.
分析:(1)先算出碳酸钙的质量,然后写出化学方程式计算出二氧化碳的质量.
(2)由(1)计算出氯化氢的质量,然后计算出溶液的质量分数.
(2)由(1)计算出氯化氢的质量,然后计算出溶液的质量分数.
解答:解:(1)碳酸钙的质量=25×80%═20克,设生成的二氧化碳的质量为X,需要氯化氢的质量是Y.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
20克 Y X
═
得:X=8.8克
═
得:Y=14.6克
(2)稀盐酸中溶质的质量分数=
×100%═7.3%.
答:生成二氧化碳气体的质量为8.8克;稀盐酸中溶质的质量分数为7.3%.
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73 44
20克 Y X
| 100 |
| 44 |
| 20克 |
| X |
得:X=8.8克
| 100 |
| 73 |
| 20克 |
| Y |
得:Y=14.6克
(2)稀盐酸中溶质的质量分数=
| 14.6克 |
| 200克 |
答:生成二氧化碳气体的质量为8.8克;稀盐酸中溶质的质量分数为7.3%.
点评:掌握化学方程式的计算格式和规范性,记住溶液中溶质的质量分数的计算公式.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
长时间使用的热水壶底部有一层水垢,主要成分是CaCO3和Mg(OH)2.学校化学研究性学习小组同学通过实验想测定水垢中CaCO3的含量为多少.他们取200g水垢,加入过量的稀盐酸,同时测量5分钟(min)内生成CO2质量(已知Mg(OH)2与稀盐酸反应不能放出C02气体),测量数据如下表:
计算:(1)3min时,水垢中的CaCO3是否反应完全?请说明理由
(2)该水垢中CaCO3的质量分数是多少?
| 时间/min | 1 | 2 | 3 | 4 | 5 |
| 生成CO2的质量/g | 18 | 25 | 30 | 33 | 33 |
(2)该水垢中CaCO3的质量分数是多少?
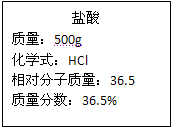 实验室有一瓶浓盐酸,瓶上标签的部分内容如图所示,请你根据标签上提供的数据解答下列问题:
实验室有一瓶浓盐酸,瓶上标签的部分内容如图所示,请你根据标签上提供的数据解答下列问题: