题目内容
生石灰(CaO)与水反应生成熟石灰[Ca(OH)2],熟石灰可用于改良酸性土壤.根据信息写出生石灰与水反应的化学方程式 (1)
CaO+H2O═Ca(OH)2
CaO+H2O═Ca(OH)2
,基本反应类型是 (2)化合反应
化合反应
.分析:生石灰(CaO)与水反应生成熟石灰[Ca(OH)2],写出反应的化学方程式即可,由反应特征确定反应类型.
解答:解:(1)生石灰与水反应生成氢氧化钙,反应的化学方程式为:CaO+H2O═Ca(OH)2.
(2)该反应符合“多变一”的特征,属于化合反应.
故答案为:(1)CaO+H2O═Ca(OH)2;(2)化合反应.
(2)该反应符合“多变一”的特征,属于化合反应.
故答案为:(1)CaO+H2O═Ca(OH)2;(2)化合反应.
点评:本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.

练习册系列答案
相关题目
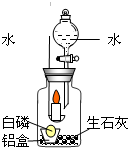 某化学实验小组在探究物质燃烧条件时,用一个集气瓶罩住燃着的小蜡烛,小蜡烛一会儿就熄灭了.它为什么会熄灭呢?每个人都提出了不同的猜想.
某化学实验小组在探究物质燃烧条件时,用一个集气瓶罩住燃着的小蜡烛,小蜡烛一会儿就熄灭了.它为什么会熄灭呢?每个人都提出了不同的猜想.[猜想]甲同学猜想:蜡烛燃烧耗尽了瓶内的氧气,所以它熄灭了;
乙同学猜想:蜡烛燃烧后,瓶内二氧化碳的浓度过高导致了蜡烛熄灭;
丙同学猜想:甲、乙两位同学都只看到了问题的一个方面,他认为两人的猜想都有道理;
丁同学猜想:
[查阅资料]①白磷的着火点是40℃;②生石灰(CaO)与水发生化学
反应:CaO+H2OCa(OH)2,同时放出大量的热.
[实验设计]大家激烈地讨论,很难达成一致.于是丁同学设计了如右图所示的装置来验证自己的猜想.
| 实验步骤 | 实验现象 | 实验分析 | 实验结论 |
| 1.取一小块白磷放在一铝箔制的小盒中,然后放入装有生石灰的集气瓶内,点燃蜡烛,塞紧胶塞,观察现象. | 燃烧的蜡烛一会儿就熄灭了. | 蜡烛燃烧需满足的条件: ①温度达到着火点 ② |
丁同学的猜想是正确的 |
| 2.待冷却后,打开分液漏斗活塞,向集气瓶中注入少量的水,立即关闭活塞,观察现象. | 铝盒中的白磷燃烧,放出热量的同时产生了白烟. | 白磷燃烧满足的条件与蜡烛燃烧的条件相同,白磷燃烧的方程式: |
[实验反思]①在该实验中,生石灰的主要作用是
②实验结束后,集气瓶底部的固体中可能含有哪些成分?(写出三种即可)

 如图是这种枇杷的部分营养成分,请据图回答:
如图是这种枇杷的部分营养成分,请据图回答: